Les biothérapies
Les biothérapies sont des traitements indiqués dans diverses pathologies et disciplines médicales : oncologie, rhumatologie, médecine interne, gastro-entérologie… Cette vaste famille de médicaments regroupe notamment des substances qui « copient » les molécules naturelles du corps humain. On y retrouve par exemple des anticorps monoclonaux.
L’objectif de ces thérapeutiques est d’agir de façon extrêmement ciblée sur un élément clé et précis de la physiopathologie : bloquer une cytokine, une protéine ou un récepteur central dans les mécanismes pathologiques identifiés.
Par une action ciblée sur un élément, le but est de limiter le risque d’effets indésirables des traitements. Mais les cibles étant impliquées dans des processus pathologiques, mais également physiologiques, des effets indésirables s’observent tout de même ; ces molécules peuvent alors générer un risque infectieux chez les patients.
Risque local ou général par immunodépression
Les cibles de ces médicaments sont souvent des acteurs de la réponse inflammatoire ou immunitaire. Prenons l’exemple des traitements anti-TNF alpha, souvent utilisés dans des pathologies rhumatologiques chroniques telles que la polyarthrite rhumatoïde. Le blocage de son activité permet une diminution de l’inflammation, donc une amélioration des scores de douleur et de qualité de vie notamment ; cependant, le TNF alpha étant libéré à la suite d’une infection bactérienne ou virale, il semble évident que son blocage entraîne un risque infectieux par diminution de cette réponse immunitaire.
Risque local par risque d’ostéonécrose
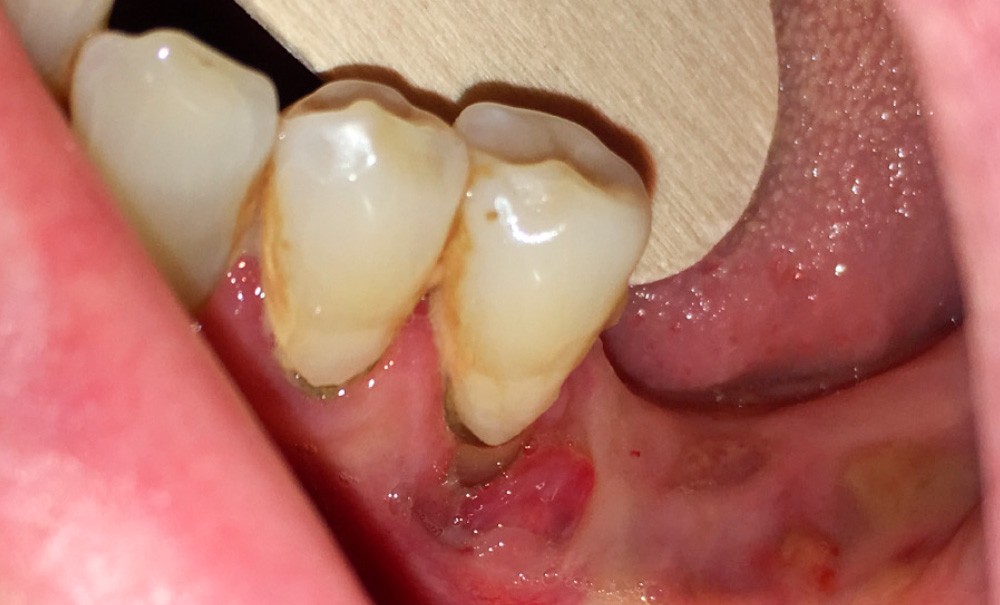
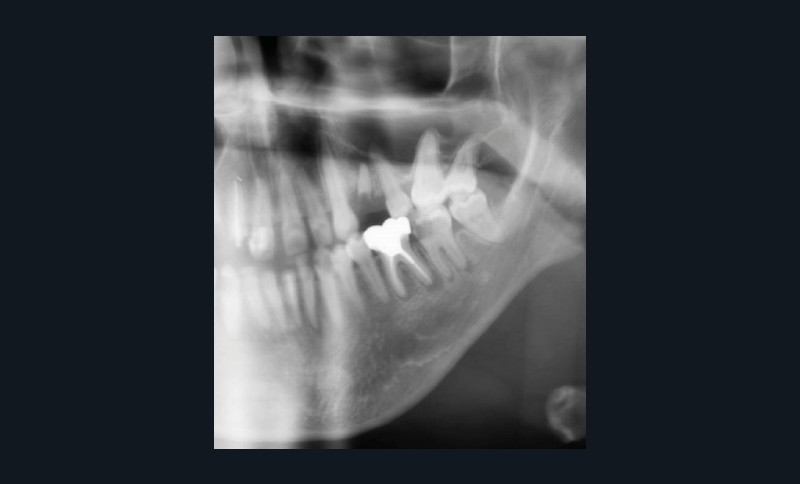
Le principal risque d’ostéonécrose en lien avec une biothérapie est dû à l’inhibiteur du RANKL, le dénosumab (commercialisé sous le nom de Xgeva® en indication oncologique, Prolia® en indication rhumatologique) (fig. 1). Cet anticorps bloque la liaison du RANKL à son récepteur, qui permet notamment l’activation des ostéoclastes. La résorption osseuse est alors bloquée, action intéressante dans le cadre d’une ostéoporose ou de métastases osseuses. Cependant, même si le mécanisme d’action est totalement différent, on retrouve les mêmes effets indésirables que ceux observés avec les bisphosphonates au niveau de la cavité orale. Les patients traités par anti-RANKL présenteront un risque d’ostéonécrose des mâchoires. Ce risque sera évidemment plus ou moins important en fonction de facteurs à rechercher : indication du traitement (oncologique ou rhumatologique), durée totale du traitement, date de dernière administration, corticothérapie associée, diabète, présence de foyers infectieux bucco-dentaires…
D’autres biothérapies sont susceptibles d’entraîner ce même type de risque infectieux local à type d’ostéonécrose, comme les anti-angiogéniques. Cependant, leur rôle est discuté dans la littérature ; ils semblent agir davantage comme facteur de risque lorsqu’ils sont associés aux bisphosphonates ou au dénosumab, que comme une cause isolée.
Il ne s’agit que de quelques exemples parmi les risques liés à ces biothérapies.
Conduite à tenir au cabinet dentaire
Le chirurgien-dentiste est donc régulièrement confronté à la gestion des biothérapies sous divers aspects.
Recherche de foyers infectieux avant instauration du traitement par biothérapie
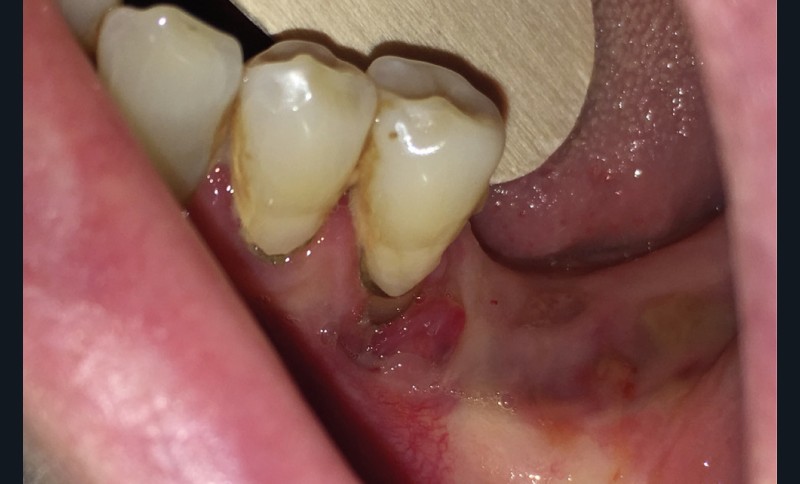
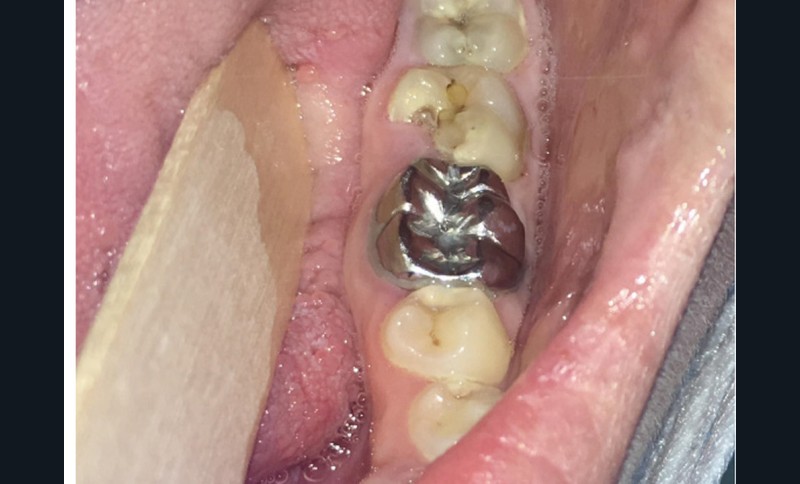
Dans le bilan avant mise en place du traitement, les recommandations, notamment de rhumatologie, indi-quent la réalisation d’un bilan dentaire et la mise en œuvre des soins nécessaires [1]. Cela a pour but d’identifier les foyers infectieux en présence et de les prendre en charge avant que le traitement ne débute, donc avant que le patient présente un risque infectieux accru (fig. 2).
L’attitude face à ces foyers infectieux, au-delà du pronostic de chaque dent, dépendra de facteurs, généraux notamment : thérapeutique mise en place (donc risque infectieux précis pour le patient), durée estimée du traitement (et donc du risque), le pronostic de la pathologie, la présence de facteurs de risque majorant le risque infectieux ou encore la compliance du patient [2].
Gestion des foyers infectieux en cours et après traitement
Selon la biothérapie concernée, l’acte et la pathologie infectieuse orale, des précautions seront à mettre en place.
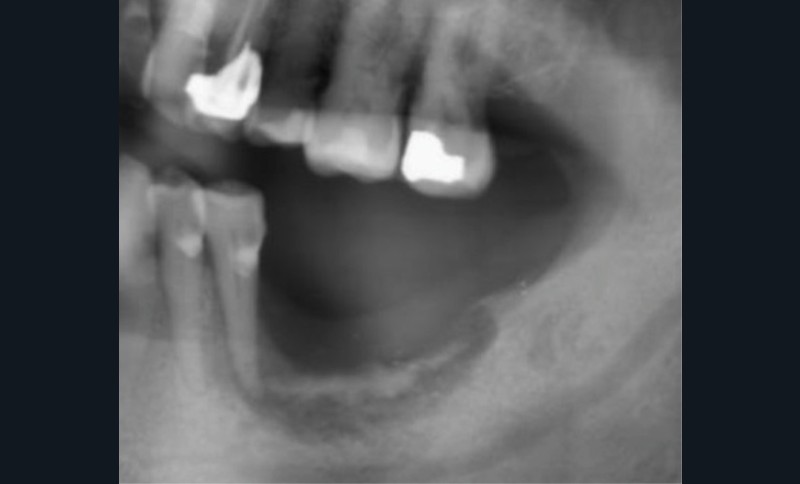
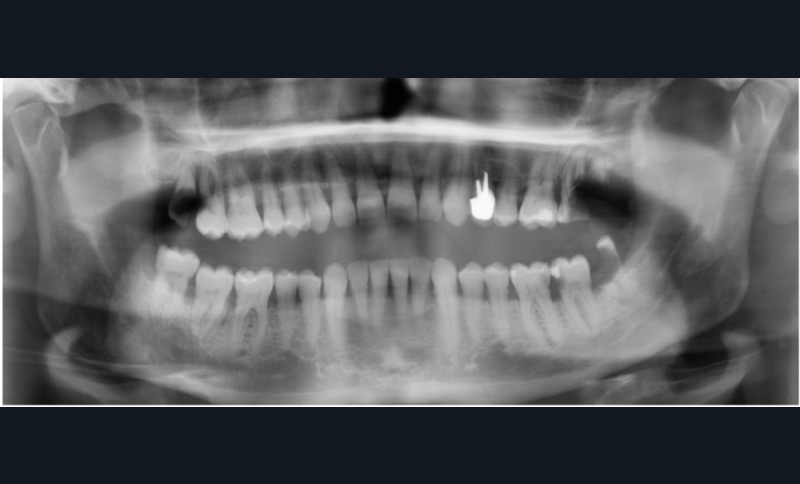
Pour les actes invasifs, une suspension de traitement pourra être discutée avec le médecin prescripteur, afin de réduire le risque infectieux au moment de l’acte, mais aussi en postopératoire [1, 2]. La thérapeutique sera reprise lorsque la cicatrisation sera complète. Il est évident que cette suspension de traitement ne doit pas altérer le pronostic de la pathologie et l’état général du patient. En cas d’urgence, les actes nécessaires doivent être entrepris sans délai (fig. 3).
Les actes invasifs seront généralement précédés d’une antibioprophylaxie, qui pourra être prolongée en fonction de deux éléments : la nature de l’acte et le risque infectieux propre au patient [3].
Prévention des complications en cours et après traitement
Enfin, le chirurgien-dentiste sera amené à proposer une prévention adaptée aux risques du patient : le calendrier de suivi sera parfois différent (consultation tous les 6 mois par exemple), et des thérapeutiques fluorées pourront être proposées pour limiter le risque carieux [2].
Conclusion
La diversité des thérapeutiques de type biothérapie et l’arrivée constante sur le marché de nouvelles molécules complexifient la gestion au cabinet dentaire des patients bénéficiant de ces traitements. Il apparaît ici que la connaissance de ces thérapeutiques, des risques qu’elles génèrent et des recommandations qui les concernent dans la prévention et la prise en charge du risque infectieux est essentielle pour le chirurgien-dentiste.








Commentaires