Résumé
Objectifs
> La péri-implantite, pathologie d’origine bactérienne, affecte 20 % des implants et 10 % des patients. Il n’existe pas de thérapeutique gold standard pour la traiter. L’implantoplastie, c’est-à-dire la modification mécanique de l’implant, incluant le retrait du filetage et l’élimination du revêtement de la surface implantaire, a été proposée comme traitement chirurgical des péri-implantites. L’objectif de la présente revue est d’évaluer systématiquement la littérature pour répondre à la question ciblée « Quels sont les résultats cliniques de la procédure d’implantoplastie pour le traitement des péri-implantites en termes de survie et de paramètres cliniques et radiographiques ? ».
Matériels et méthodes
> Une recherche systématique de la littérature a été réalisée avec le mot-clé « implantoplasty » sur MEDLINE (PubMed), Cochrane, EMBASE, ainsi qu’une recherche manuelle jusqu’au 1er mars 2021. Toutes les études cliniques humaines (essais cliniques randomisés, études prospectives ou rétrospectives) impliquant une implantoplastie dans le traitement des péri-implantites ont été incluses, et tous les résultats liés à l’implantoplastie ont été enregistrés et résumés.
Résultats
> Vingt-six publications parmi les 153 identifiées ont été incluses dans la présente revue.
Conclusion
> Sur la base de toutes ces données cliniques et radiologiques, et dans les limites de comparabilité des études incluses et analysées dans cette revue, la procédure d’implantoplastie au cours du traitement chirurgical d’une lésion péri-implantaire permet d’augmenter le taux de survie implantaire et d’améliorer les paramètres cliniques (diminution des profondeurs de poche au sondage, du saignement au sondage) et radiologiques. L’application clinique qui découle de ces premiers résultats donnerait une certaine légitimité pour inclure l’implantoplastie dans les protocoles chirurgicaux de traitement des lésions péri-implantaires. D’autres études doivent être entreprises afin de confirmer cette efficacité thérapeutique et de rechercher d’autres méthodes de conditionnement de la surface implantaire faisant suite à une lésion péri-implantaire.
La santé péri-implantaire est définie par une absence d’érythème, de gonflement, de saignement et/ou d’une suppuration au sondage (BOP/SOP), et peut exister sur un support péri-implantaire réduit [1].
La péri-implantite est définie comme une pathologie associée à la plaque affectant les tissus autour des implants, caractérisée par une inflammation de la muqueuse péri-implantaire et une perte progressive de l’os de soutien.
On constate des signes cliniques d’inflammation, des saignements ou une suppuration lors du sondage, une augmentation des profondeurs de sondage et/ou une récession de la muqueuse marginale associés à une perte osseuse radiographique par rapport aux examens radiologiques précédents [2].
Parmi les facteurs de risques à haut niveau de preuve, on retrouve les patients qui présentent un historique de maladie parodontale, un mauvais contrôle de plaque, ou ne suivant pas de protocole de maintenance régulier [3]. Le tabac et les maladies systémiques, comme le diabète, sembleraient également jouer un rôle néfaste mais sans confirmation scientifique à ce stade [3].
Les implants présentent différents états de surface qui sont définis en fonction de la rugosité de surface mesurée par la valeur de Sa (surface roughness) :
- lisse (Sa < 0,5 μm) ;
- peu rugueux (Sa entre 0,5 et 1,0 μm) ;
- moyennement rugueux (Sa entre 1,0 et 2,0 μm) ;
- rugueux (Sa > 2,0 μm).
La surface originale usinée de Brånemark, présentée comme lisse, avait un Sa de 0,9 μm [4].
L’état de surface des implants a un effet sur la prévalence des péri-implantites, leur vitesse de progression et la réponse au traitement.
Il a été prouvé que les surfaces rugueuses permettent une accumulation de plaque plus importante que les surfaces lisses [5, 6], suggérant qu’en cas d’exposition de la surface implantaire au milieu buccal, l’os marginal entourant un implant modérément rugueux peut être plus vulnérable au développement d’une péri-implantite que l’os entourant un implant avec une surface peu rugueuse. Le sujet fait débat puisqu’une revue systématique de la littérature de 2018 de Jordana et coll., incluant 22 articles avec 5 329 implants, a conclu que l’état de surface rugueux était un facteur de risque associé au développement de la péri-implantite [7], tandis qu’une autre revue systématique incluant 8 articles avec 2 992 implants n’a pas trouvé de lien entre état de surface et incidence des péri-implantites [8] ; preuve que les facteurs de risques liés au patient, ainsi que la qualité/quantité des tissus mous entourant les implants, peuvent constituer des déterminants importants dans la survenue de la maladie.
Concernant l’état de surface et la vitesse de progression des péri-implantites, Albouy et coll. ont créé des péri-implantites expérimentales chez le chien sur des implants à état de surface lisse ou rugueux. Ils ont observé des différences significatives dans la perte osseuse et dans l’atteinte tissulaire ; que ce soit pour la profondeur de poche au sondage (PPS) ou l’extension de l’infiltrat inflammatoire dans le tissu conjonctif, plus importantes pour les implants présentant un état de surface rugueux [9].
Pour ce qui est du lien entre état de surface et résultats du traitement des péri-implantites, des études ont montré qu’il est plus difficile de décontaminer des surfaces rugueuses [10].
Dans une étude prospective sur le traitement de péri-implantites sévères chez 100 patients, le succès du traitement à 1 an est plus élevé autour des implants avec une surface usinée et non modifiée qu’autour des implants à surfaces rugueuses/modifiées [11].
De plus, 3 ans après traitement chirurgical, la récidive de la péri-implantite est plus fréquente chez les patients avec des implants à surface rugueuse ou modifiée [12].
Après 5 ans, les auteurs montrent que les implants à état de surface modifiée présentent cinq fois plus de risque de récidive ou de progression de la péri-implantite [13].
Enfin, une étude à 11 ans a montré de meilleurs résultats après traitement chirurgical des péri-implantites sur des implants à surface usinée que sur des implants à surface rugueuse et modifiée [14].
Une méta-analyse suggère que la perte osseuse autour des implants à état de surface peu rugueux est statistiquement moins importante par rapport aux implants moyennement rugueux et rugueux [15].
Puisque les implants usinés présentent des caractéristiques plus favorables, l’idée est venue de rendre lisse cet état de surface rugueux, de manière à optimiser les résultats de traitement et limiter le risque de récidive.
Plusieurs méthodes de détoxification des surfaces implantaires contaminées en présence d’une péri-implantite sont décrites (seule ou en association) :
- aéropolissage ;
- brossage avec des brosses en titane ;
- débridement ultrasonore ou manuel ;
- laser ;
- électrolytique [16] ;
- techniques chimiques (EDTA, chlorhexidine, eau oxygénée, tétracyclines, acide citrique) ;
- lissage de l’implant à l’aide de fraises (implantoplastie) [17].
L’élimination du microbiote péri-implantaire organisé en biofilm sur la surface implantaire est difficile et justifie l’utilisation de techniques invasives modifiant cet état de surface. Cette modification à l’échelle macroscopique permet d’éliminer le facteur étiologique microbien organisé en biofilm.
L’implantoplastie permet d’obtenir de bons résultats à condition d’utiliser le bon matériel et le bon protocole. Elle permet d’éliminer les spires et de lisser l’état de surface qui est majoritairement rugueux sur les implants utilisés actuellement.
Il a récemment été démontré in vitro que l’implantoplastie était une méthode de traitement valable en termes de biocompatibilité avec les ostéoblastes [18].
De plus, une diminution significative du développement du biofilm bactérien est objectivable in vitro 48 heures après une procédure d’implantoplastie, comparé à un débridement avec des curettes en plastique, et préviendrait la recolonisation bactérienne [19]. La procédure permettrait ex vivo une élimination complète du biofilm bactérien sur la surface implantaire, avec une efficacité supérieure à d’autres techniques mécaniques (laser, brossage, aéropolissage) et chimiques (sérum physiologique, EDTA, eau oxygénée, acide citrique et phosphorique) [20].
L’élimination de la surface rugueuse et affectée du titane permet également de diminuer le potentiel d’adhérence du biofilm, et ainsi sa maturation sur la surface implantaire [21, 22].
Les études montrent une rugosité similaire entre un implant usiné [23] et un implant après procédure d’implantoplastie (Ra = 0,39 µm ± 0,13 µm) [24].
L’idée d’éliminer le revêtement implantaire est apparue pour la première fois dans un article de Lang et coll., sans donner de détails techniques [25]. Dans une étude in vitro [26], les modalités ont été précisées pour réduire la rugosité de l’état de surface dite « plasma-spray » d’implants IMZ.
La première étude humaine a été réalisée par Suh et coll. dans le cadre d’une chirurgie reconstructrice suite à une péri-implantite [27].
La procédure a consisté à éliminer les spires et le revêtement de la surface implantaire à l’aide d’instruments rotatifs, certaines fraises ayant été conçues spécifiquement à cet effet.
Les critères de réussite du traitement évalués dans les études ne sont pas toujours identiques. Ainsi, le résultat du traitement peut être évalué à l’aide de définitions distinctes. Certains auteurs définissent uniquement le taux de survie. Par exemple, résultat positif ou positive outcomes a été proposé par Renvert et coll. [28], et est défini comme une réduction moyenne de la PPS supérieure ou égale à 0,5 mm sans aucune nouvelle perte osseuse. Il ne prend pas en compte les signes cliniques inflammatoires nécessaires à la santé péri-implantaire, et peut être assimilé à un taux de survie implantaire. Un autre critère appelé « succès du traitement » est plus strict, car il inclut l’absence de BOP/SOP comme paramètres cliniques du succès. Il a été proposé par Carcuac et coll. [11], et est défini comme une PPS inférieure ou égale à 5 mm, l’absence de BOP/SOP, et aucune autre perte osseuse supérieure ou égale à 0,5 mm par rapport à la situation initiale. Ces deux définitions modifient largement les taux de succès.
L’amélioration des paramètres cliniques et radiologiques décrits dans les études concerne :
- la diminution de la PPS ;
- la diminution du BOP ;
- l’augmentation du niveau d’attache clinique (NAC) et du niveau osseux ;
- le comblement osseux ;
- la présence de récession ;
- l’indice de plaque ;
- la hauteur de tissu kératinisé ;
- certains paramètres microbiologiques.
Les critères de succès cliniques et radiologiques semblant être les plus représentatifs sont la réduction de la PPS (≤ 5 mm) sans BOP ni SOP, et l’absence de perte osseuse évolutive à 1 an postopératoire.
Matériel et méthode
Question ciblée
Quels sont les résultats cliniques et radiologiques de la procédure d’implantoplastie pour le traitement des péri-implantites ?
Protocole et critères d’éligibilité
Cette revue systématique a été menée conformément aux lignes directrices des revues systématiques et des méta-analyses (PRISMA) [29], ainsi que la méthode patient, intervention, comparaison et résultats (PICO) :
- P : patients d’au moins 18 ans avec une ou plusieurs lésions péri-implantaire ;
- I : péri-implantite traitée chirurgicalement avec une procédure d’implantoplastie (partielle ou totale). Cela comprend : chirurgie régénératrice et/ou résectrice avec différents protocoles de décontamination ;
- C : situation initiale et situation après procédure d’implantoplastie (3 mois de suivi minimum) ;
- O : taux de survie et/ou taux de succès.
- Critères de jugement secondaires : profondeur de poche au sondage (PPS), saignement (BOP) et/ou suppuration (SOP) au sondage, niveau d’attache clinique (NAC), niveau osseux, comblement osseux, récession, hauteur de tissu kératinisé, score/indice de plaque, critères microbiologiques.
Les critères d’inclusion suivants ont été appliqués lors de la recherche documentaire sur les études originales sans restriction d’année de publication : (a) études cliniques humaines sur les implants dentaires atteints de péri-implantite soumis à une implantoplastie ; (b) texte intégral disponible.
Sources d’information et recherche documentaire
La recherche électronique avec le terme « implantoplasty » a été effectuée sur trois sources (dernière recherche le 1er mars 2021 ; aucune restriction de date utilisée) : MEDLINE (PubMed), Cochrane et Embase. Une recherche manuelle a également été effectuée en examinant la revue systématique sur les complications après procédure d’implantoplastie de Stavropoulos et coll. (2019).
Deux auteurs ont vérifié le titre, le résumé, et enfin le texte intégral, sur les critères d’éligibilité prédéfinis. Puis les données suivantes ont été extraites (si disponibles) : auteur, année de publication, conception de l’étude, critères d’inclusion, objectif et protocole de l’étude, nombre de patients et d’implants, durée de suivi, procédure clinique, critères de succès, résultats. Si elles ne sont pas spécifiquement déclarées, les données/valeurs ont été calculées à partir des graphiques/tableaux inclus dans les publications le cas échéant.
Résultats
Sélection des études
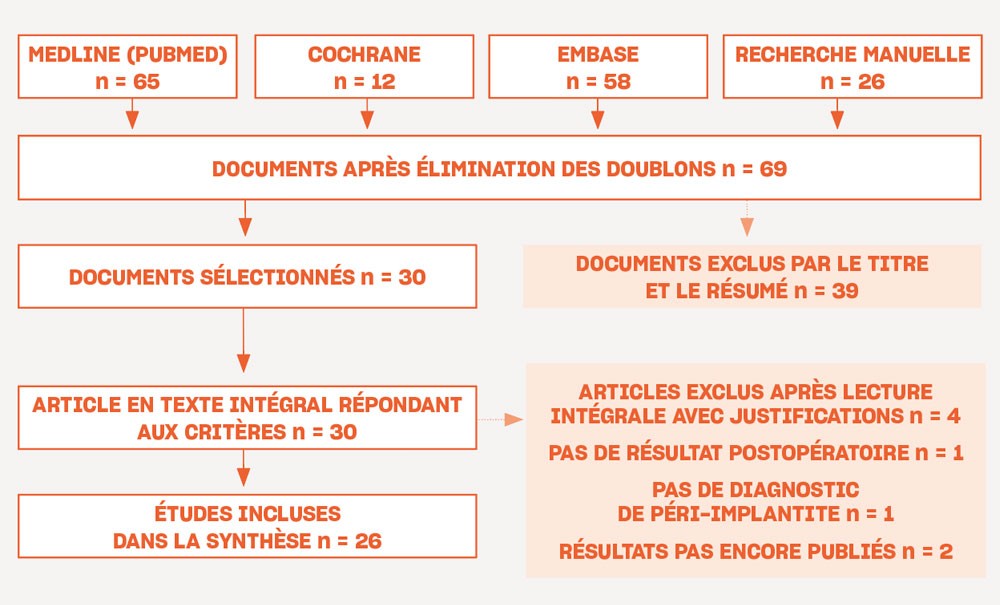
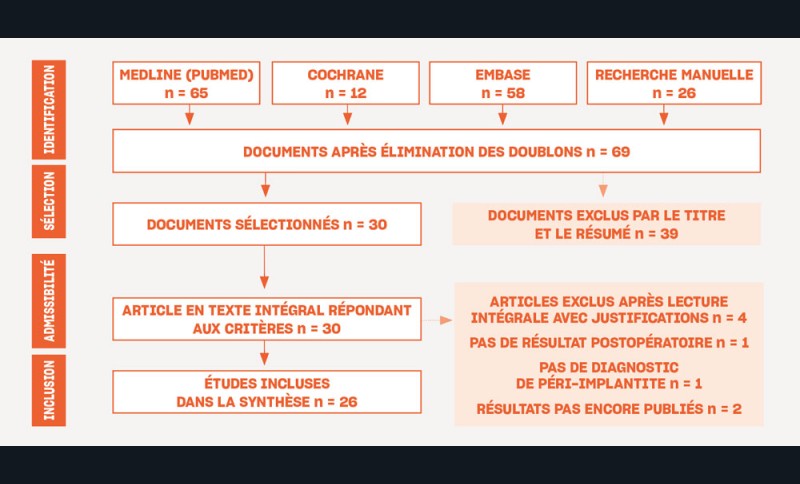
L’organigramme de la recherche de la littérature est présenté sur la figure 1.
Sur un total de 153 études sélectionnées, 26 ont été incluses dans l’étude : Suh et coll., 2003 ; Romeo et coll., 2005 ; Romeo et coll., 2007 ; Schwarz et coll., 2011 ; Schwarz et coll., 2012 ; Schwarz et coll., 2013 ; Thierbach et coll., 2013 ; Schwarz et coll., 2014 ; Schwarz et coll., 2014 ; Matarasso et coll., 2014 ; Schwarz et coll., 2015 ; Sapata et coll., 2016 ; Pommer et coll., 2016 ; Schwarz et coll., 2017 ; Geremias et coll., 2017 ; Englezos et coll., 2018 ; Nart et coll., 2018 ; Ramanauskaite et coll., 2018 ; Bianchini et coll., 2019 ; Dalago et coll., 2019 ; Austoni et coll., 2019 ; Bianchini et coll., 2020 ; Lasserre et coll., 2020 ; Galarraga et coll., 2020 ; Ravidà et coll., 2020 ; Wang et coll., 2021.
Caractéristiques des études
Dans l’ensemble, les études sélectionnées ont été publiées entre 2003 et 2021. Elles comprenaient 9 essais cliniques randomisés, 8 séries de cas prospectifs, 4 rapports de cas et 5 analyses rétrospectives sur 466 implants soumis à une procédure d’implantoplastie avec un suivi de 3 mois jusqu’à 9 ans. Au total, 519 patients atteints de péri-implantite ont été étudiés.
Méthode d’évaluation de la qualité des études
Les risques de biais des essais cliniques randomisés ont été évalués à l’aide de Rob 2 (tableaux 1, 3) [30].
L’échelle de Newcastle-Ottawa a été utilisée comme méthode d’évaluation de la qualité des études non randomisées (tableaux 2, 4) [31].
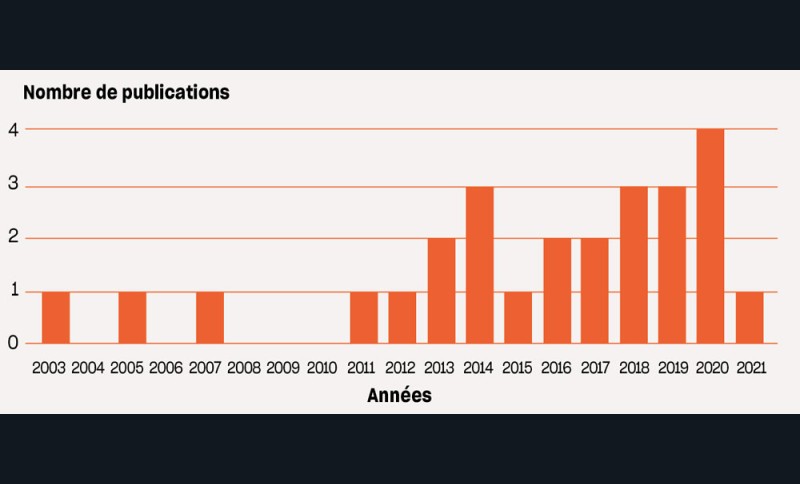
Distribution des études
La distribution des études par année de publication (fig. 2) montre que le traitement des maladies péri-implantaires est un sujet d’intérêt croissant, en lien avec une prévalence de plus en plus importante de ces pathologies [32].
Résumé des résultats
Les résultats seront exprimés selon les critères évalués qui permettront de répondre à deux questions, et présentés selon le niveau de preuve des études analysées.
Première question
L’implantoplastie permet-elle d’améliorer le taux de survie implantaire ?
Essais comparatifs randomisés (tableau 1)
- Lasserre et coll. ont traité 22 implants par implantoplastie avec un suivi à 6 mois. Selon les critères de Renvert, le taux de résultat positif était de 70 % dans le groupe ayant reçu une implantoplastie ; selon ceux de Carcuac et coll., le taux de résultat positif était de 15 % [33].
- Romeo et coll. ont comparé la chirurgie résectrice associée à l’implantoplastie (19 implants) et la chirurgie résectrice seule (16 implants) pour le traitement des péri-implantites sur des implants à état de surface TPS (Titanium Plasma Spray, Straumann) avec un suivi de 3 ans. La chirurgie associée à l’implantoplastie a amélioré le taux de survie de 100 % (cependant 89,29 % des implants présentaient un BOP ponctuel et 10,71 % un BOP abondant). La chirurgie résectrice seule a amélioré le taux de survie de 87,5 % [34].
- Dans une autre étude, les mêmes auteurs sont arrivés à la même conclusion : l’implantoplastie améliorait le taux de survie (100 % sur 20 implants traités avec implantoplastie contre 77,6 % sur 18 implants traités sans implantoplastie [35]).
- Dalago et coll. ont obtenu un taux de survie de 100 % des cas dans le groupe ayant reçu une implantoplastie (9 implants) ; 88,89 % dans le groupe n’ayant pas reçu d’implantoplastie et ayant été traité à l’acide citrique (9 implants) ; 83,33 % dans le groupe n’ayant pas reçu d’implantoplastie, mais une greffe de tissu conjonctif (9 implants) à 3 ans [36].
|
Tableau 1. Résultats des études cliniques randomisées. Données brutes issues des publications |
||||
|
Études |
Détails de la population : a. Nombre de patients b. Procédure c. Nombre d’implants avec implantoplastie d. Nombre d’implants sans implantoplastie e. Durée du suivi |
Critère(s) de succès |
Résultats |
Risque de biais Rob2 [30] |
|
Romeo et coll. (2005) [34] |
a. 17 b. Résectrice c. 19 d. 16 e. 36 mois |
Taux de survie |
Groupe implantoplastie : 100 % mais 89,29 % des implants présentent un saignement ponctuel au sondage et 10,71 % un saignement abondant Groupe sans implantoplastie : 87,5 % |
Certaines inquiétudes |
|
Romeo et coll. (2007) [35] |
a. 19 b. Résectrice c. 20 d. 18 e. 36 mois |
Taux de survie Taux de survie selon les critères d’Albrektsson et coll. (1986) : absence de perte osseuse marginale supérieure à 1 mm la première année puis 0,2 mm les années suivantes |
Groupe implantoplastie : 100 % (90 % avec une perte osseuse selon les critères d’Albrektsson et coll.) Groupe sans implantoplastie : 77,8 % > Différence significative |
Certaines inquiétudes |
|
Dalago et coll. (2019) [36] |
a. 27 b. Résectrice c. 9 d. 18 e. 3 ans |
Taux de survie Résolution de la maladie : absence de poche ≥ 5 mm, de saignement/suppuration au sondage et de perte osseuse radiographique |
Groupe débridement et acide citrique Taux de survie : 88,89 % Résolution de la maladie : 50 % Groupe tissu conjonctif Taux de survie : 83,33 % Résolution de la maladie : 60 % Groupe implantoplastie Taux de survie : 100 % Résolution de la maladie : 62,5 % |
Certaines inquiétudes |
|
Lasserre et coll. (2020) [33] |
a. 31 b. Résectrice c. 22 d. 20 e. 6 mois |
Taux de survie ou résultats positifs : réduction moyenne de la profondeur de poche ≥ 0,5 mm sans aucune nouvelle perte osseuse Taux de succès : poche ≤ 5 mm sans saignement ou suppuration au sondage, ou perte osseuse ≥ 0,5 mm |
Groupe implantoplastie Taux de survie : 70 % Taux de succès : 15 % Groupe aéropolissage Taux de survie : 68 % Taux de succès : 26 % > Différences non significatives |
Bas |
Études rétrospectives et série de cas n > 30 (tableau 2)
- Dans une étude rétrospective, Pommer et coll. n’ont pas montré de différences significatives des taux de survie à long terme (9 ans) entre le groupe ayant reçu une implantoplastie (87 %), celui ayant reçu une implantoplastie et un traitement au laser (83 %) et celui ayant été traité au laser seul (92 %) [37].
- Ravidà et coll. n’ont pas trouvé pas de différences significatives dans les taux de survie entre le groupe ayant reçu une implantoplastie (90 % sur 30 implants) et celui n’ayant pas reçu d’implantoplastie (81,6 % sur 38 implants) ; ni entre les taux de succès, plus faibles à 1 an (33,3 % et 36,8 % dans le premier groupe contre 44,7 % et 40,9 % dans le second selon les critères de Berglundh et coll. [14] et Bianchini et coll. [39] respectivement) [38].
- En 2019, dans une étude rétrospective (2 à 6 ans) sur 32 implants, Bianchini et coll. ont montré 87 % de survies, mais uniquement 33 % de succès [39].
- En 2018, l’étude rétrospective de Ramanauskaite et coll. sur 3,5 ans a également obtenu des résultats moindres selon des critères de succès plus stricts (résolution de la maladie) avec 33 % des 57 implants [40].
- Englezos et coll. ont rapporté 100 % de survies à 2 ans dans leur série de cas sur 40 implants [41].
Série de cas n < 30 (tableau 2)
- Dans une étude prospective sur 1 an concernant une série de cas (11 implants), Matarasso et coll. ont montré un taux de survie de 100 % [42]. Nart et coll. ont également relevé un taux de survie de 100 % à 1 an dans une étude portant sur 17 implants [43] ; Bianchini et coll., un taux de survie de 100 % à 3 ans pour 4 implants [44].
- L’étude pilote de Galarraga et coll., dont l’objectif primaire était d’analyser la contraction tissulaire postopératoire après le traitement chirurgical de la péri-implantite par procédure d’implantoplastie et régénération, a montré un taux de survie des implants de 100 %.
- Suh et coll., dans leurs deux rapports de cas, ont obtenu un « arrêt de la maladie et une régénération osseuse » dans 100 % des cas [27]. Austoni et coll. ont également atteint un taux de succès de 100 % avec l’association d’une procédure régénératrice sur 6 implants [45]. Sapata et coll. ont obtenu 100 % de succès avec une implantoplastie associée à une procédure résectrice (2 implants) [46].
Conclusion
L’analyse de cette littérature met à disposition des données probantes (basées sur les études comparatives randomisées) permettant de conclure que l’implantoplastie au cours du traitement chirurgical des lésions péri-implantaires permet d’obtenir un taux de succès thérapeutique compris entre 15 % (Lasserre et coll.) et 62,5 % (Dalago et coll.), et un taux de survie implantaire compris entre 70 % (Lasserre et coll.) et 100 % (Romeo et coll.), supérieurs à ceux de la chirurgie résectrice sans implantoplastie.
Par ailleurs, selon les études observationnelles, il est permis de penser que l’implantoplastie est plus souvent en lien avec un fort taux de succès thérapeutique et de survie implantaire.
|
Tableau 2. Résultats des études cliniques non randomisées. Données brutes issues des publications |
||||
|
Étude Type d’étude |
Détails de la population : a. Nombre de patients b. Procédure c. Nombre d’implants avec implantoplastie d. Nombre d’implants sans implantoplastie e. Durée du suivi |
Critère(s) de succès |
Résultats |
Échelle de Newcastle-Ottawa [31] |
|
Pommer et coll. (2016) [37] Étude rétrospective |
a. 142 b. Résectrice c. 70 d. 72 e. 9 ans |
Taux de survie (échec = perte de l’implant) |
Groupe implantoplastie : 87 % Groupe implantoplastie et laser : 83 % Groupe laser : 92 % > Différences non significatives |
8 |
|
Ravidà et coll. (2020) [38] Étude rétrospective |
a. 41 b. Résectrice c. 30 d. 38 e. 1 an |
Taux de survie Taux de succès selon les critères de Berglundh et coll. [14] : absence de saignement au sondage, perte osseuse ≤ à 0,5 mm, profondeur de sondage ≤ 5 mm Taux de succès selon les critères de Bianchini et coll. [39] : absence de perte osseuse et de saignement au sondage |
Groupe implantoplastie Taux de survie : 90 % Taux de succès [14] : 33,3 % Taux de succès [39] : 36,8 % Groupe sans implantoplastie Taux de survie : 81,6 % Taux de succès [14] : 44,7 % Taux de succès [39] : 40,9 % > Différence non significative du taux de survie |
8 |
|
Ramanauskaite et coll. (2018) [40] Série de cas rétrospective |
a. 39 b. Combinée et résectrice c. 57 d. 0 e. 6 à 126 mois (moyenne de 42 mois) |
Résolution de la maladie : absence de saignement au sondage et de profondeur de poche ≥ 6 mm |
33 % des implants Groupe résectrice : 25 % Groupe avec technique combinée : 56,3 % |
7 |
|
Bianchini et coll. (2019) [39] Série de cas rétrospective |
a. 23 b. Résectrice c. 32 d. 0 e. 2 à 6 ans (moyenne 3,4 ± 1,5 an) |
Taux de survie ou Implants cliniquement stables (absence de perte osseuse) Mais ne prend pas en compte la profondeur de sondage, ni le saignement au sondage, s’il n’est pas associé à une perte osseuse Taux de succès selon les critères de Carcuac et coll. [11] : perte osseuse ≤ 0,5 mm sans saignement ou suppuration au sondage ni profondeur de poche > 4 mm |
87 % des implants ne présentent pas de perte osseuse évolutive Mais 10,7 % des implants présentent un saignement au sondage 33 % de succès |
6 |
|
Englezos et coll. (2018) [41] Série de cas prospective |
a. 25 b. Résectrice c. 40 d. 0 e. 24 mois |
Taux de survie |
100 % |
6 |
|
Matarasso et coll. (2014) [42] Série de cas prospective |
a. 11 b. Combinée c. 11 d. 0 e. 12 mois |
Taux de survie |
100 % |
6 |
|
Nart et coll. (2018) [43] Série de cas prospective |
a. 13 b. Combinée c. 17 d. 0 e. 12 mois |
Taux de survie |
100 % |
6 |
|
Bianchini et coll. (2020) [44] Série de cas prospective |
a. 4 b. Résectrice c. 4 d. 0 e. 3 ans |
Implants cliniquement stables (absence de perte osseuse) |
100 % des implants ne présentent pas de perte osseuse évolutive |
6 |
|
Galarraga-Vinueza et coll. (2020) [54] Série de cas prospective |
a. 20 b. Combinée c. 28 d. 0 e. 6 mois |
Évaluation des modifications volumétriques des tissus |
100 % de taux de survie Contraction tissulaire postopératoire influencée par la hauteur de tissu kératinisé |
5 |
|
Austoni et coll. (2019) [45] Série de cas |
a. 5 b. Régénératrice c. 6 d. 0 e. 1 an |
Résolution de la maladie : absence de poche ≥ 5 mm, de saignement ou suppuration au sondage, et de perte osseuse radiographique |
100 % de succès Profondeur de poche < 5 mm (moyenne de 3,38 ± 0,58 mm) Aucun signe d’inflammation Aucune résorption osseuse |
5 |
|
Sapata et coll. (2016) [46] Rapport de cas |
a. 1 b. Résectrice c. 2 d. 4 e. 24 mois |
Profondeur de poche < 4 mm, absence de saignement ou suppuration au sondage et de perte osseuse radiographique |
100 % |
2 |
|
Suh et coll. (2003) [27] Rapport de 2 cas |
a. 2 b. Régénératrice c. 2 d. 0 e. 6 mois |
Arrêt de la maladie et régénération osseuse |
100 % |
2 |
Tableau 3. Résultats des études cliniques randomisées sur les paramètres cliniques après procédure d’implantoplastie. Données brutes issues des publications
|
Étude |
Détails de population : a. Nombre de patients b. Procédure c. Nombre d’implants avec implantoplastie d. Nombre d’implants sans implantoplastie e. Durée du suivi |
Diminution de la profondeur de poche |
Diminution des saignements et/ou suppurations au sondage |
Niveau d’attache |
|
Romeo et coll. (2005) [34] |
a. 17 b. Résectrice c. 19 d. 16 e. 36 mois |
De 5,78 mm (initial) à 3,21 mm (36 mois) |
2,83 (initial) à 0,61 (36 mois) (indice de saignement modifié) |
5,5 mm (initial) à 5,18 mm (36 mois) |
|
Romeo et coll. (2007) [35] |
a. 19 b. Résectrice c. 20 d. 18 e. 36 mois |
– |
– |
– |
|
Schwarz et coll. (2011) [47] |
a. 30 b. Combinée c. 35 d. 0 e. 6 mois |
– |
Groupe laser : 47,8 ± 35,5 % Groupe curettes et sérum physiologique : 55,0 ± 31,1 % |
Groupe laser : 1,5 ± 1,4 mm Groupe curettes et sérum physiologique : 2,2 ± 1,4 mm |
|
Schwarz et coll. (2012) [48] |
a. 24 b. Combinée c. 26 d. 0 e. 24 mois |
– |
Groupe laser : 75,0 ± 32,6 % Groupe curettes et sérum physiologique : 54,9 ± 30,3 % |
Groupe laser : 1,0 ± 2,2 mm Groupe curettes et sérum physiologique : 1,2 ± 2,2 mm |
|
Schwarz et coll. (2013) [49] |
a. 17 b. Combinée c. 21 d. 0 e. 48 mois |
– |
Groupe laser : 71,6 ± 24,9 % Groupe curettes et sérum physiologique : 85,2 ± 16,4 % |
Groupe laser : 1,2 ± 2,0 mm Groupe curettes et sérum physiologique : 1,5 ± 2,0 mm |
|
Schwarz et coll. (2017) [50] |
a. 15 b. Combinée c. 15 d. 0 e. 84 mois |
Groupe laser : 0,74 ± 1,89 mm Groupe curettes et sérum physiologique : 2,55 ± 1,67 mm |
Groupe laser : 86,66 ± 18,26 % Groupe curettes et sérum physiologique : 89,99 ± 11,65 % |
Groupe laser : 2,06 ± 2,52 mm Groupe curettes et sérum physiologique : 2,76 ± 1,92 mm |
|
Dalago et coll. (2019) [36] |
a. 27 b. Résectrice c. 9 d. 18 e. 3 ans |
De 6,38 ± 0,53 mm (initial) à 4,13 ± 0,40 mm (3 ans) |
Saignement au sondage : de 4,5 ± 0,57 % (initial) à 1,25 ± 0,53 % (3 ans) Indice gingival : de 0,75 ± 0,37 (initial) à 0,25 ± 0,16 (3 ans) |
– |
|
Lasserre et coll. (2020) [33] |
a. 31 b. Résectrice c. 22 d. 20 e. 6 mois |
De 6,72 ± 1,78 mm (initial) à 2,73 ± 1,59 mm (6 mois) |
Saignement au sondage : de 94,7 ± 10,7 % (initial) à 33,3 ± 24,2 % (6 mois) Suppuration au sondage : de 50 % (initial – 11 implants) à 20 % (6 mois – 4 implants) Score de saignement total : 24 ± 30 % (initial) à 19 ± 21 % (6 mois) |
De 0,23 ± 0,48 mm (initial) à 0,75 ± 0,71 mm (6 mois) |
|
Wang et coll. (2021) [51] |
a. 24 b. Combinée c. 24 d. 0 e. 6 mois |
Groupe laser : 2,65 ± 2,14 mm Groupe contrôle : 1,85 ± 1,71 mm |
Groupe laser Saignement au sondage : diminution de 0,31 ± 0,62 Indice gingival : diminution de 1,14 ± 1,15 Groupe contrôle Saignement au sondage : diminution de 0,39 ± 0,55 Indice gingival : diminution de 1,04 ± 0,89 |
Groupe laser : 1,90 ± 2,28 mm Groupe contrôle : 1,47 ± 1,76 mm |
|
Niveau osseux |
Comblement osseux |
Récession |
Indice de plaque |
Hauteur de tissu kératinisé |
Risque de biais Rob 2 [30] |
|
– |
– |
0,5 mm (initial) à 1,96 mm (24 mois) |
– |
– |
Certaines inquiétudes |
|
Groupe implantoplastie : perte osseuse supplémentaire de 0 et 0,01 mm (en mésial et distal) à 3 ans Groupe sans implantoplastie : perte osseuse supplémentaire de 1,44 mm (mésial) et 1,54 mm (distal) à 3 ans |
– |
– |
– |
– |
Certaines inquiétudes |
|
– |
Comblement du défaut infra-osseux comparable |
Groupe laser : augmentation de 0,2 ± 0,2 mm Groupe curettes et sérum physiologique : 0,2 ± 0,3 mm |
Groupe laser : augmentation de 0,4 ± 0,5 Groupe curettes et sérum physiologique : 0,5 ± 0,6 |
– |
Bas |
|
5 implants (groupe curettes et sérum physiologique) et 4 implants (groupe laser) révèlent une translucidité accrue dans l’ancienne zone de défaut péri-implantaire |
– |
Groupe laser : augmentation de 0,1 ± 0,4 mm Groupe curettes et sérum physiologique : 0,3 ± 0,6 mm |
Groupe laser : augmentation de 0,2 ± 0,6 Groupe curettes et sérum physiologique : 0 ± 0,8 |
– |
Bas |
|
– |
– |
Groupe laser : augmentation de 0,1 ± 0,3 mm Groupe curettes et sérum physiologique : 0,3 ± 0,9 mm |
Groupe laser : augmentation de 0,4 ± 0,7 Groupe curettes et sérum physiologique : 0 ± 1,1 |
– |
Bas |
|
– |
– |
Groupe laser : augmentation de 1,36 ± 1,04 mm Groupe curettes et sérum physiologique : 0,49 ± 0,92 mm |
Groupe laser : diminution de 0,12 ± 0,6 Groupe curettes et sérum physiologique : augmentation de 0,17 ± 0,97 |
– |
Bas |
|
De 5,53 ± 0,57 mm (initial) à 6,39 ± 0,58 mm (3 ans) |
– |
– |
Indice de plaque modifié : de 1,63 ± 0,41 à 1,00 ± 0,32 (3 ans) |
De 2,25 ± 0,59 mm (initial) à 1,63 ± 0,46 mm (3 ans) |
Certaines inquiétudes |
|
Perte osseuse de 4,73 ± 2,67 mm (initial) à 4,47 ± 3,06 mm (6 mois) |
– |
De 0,23 ± 0,48 mm (initial) à 0,75 ± 0,71 mm (6 mois) |
Indice plaque local : 0,22 ± 0,27 (initial) à 0,16 ± 0,28 (6 mois) Score plaque total : de 22 ± 22 % (initial) à 18 ± 14 % (6 mois) |
– |
Bas |
|
Groupe laser : 1,27 ± 1,14 mm Groupe contrôle : 1,08 ± 1,04 mm |
Groupe laser : diminution du défaut osseux de 24,46 ± 19 % Groupe contrôle : 15,19 ± 23,56 |
– |
Groupe laser Indice de plaque : diminution de 0,18 ± 0,32 Groupe contrôle Indice de plaque : diminution de 0,20 ± 0,5 |
– |
Haut |
Études rétrospectives et série de cas n > 30 (tableau 4)
- Ravidà et coll., sur une étude rétrospective, ont obtenu une réduction de la profondeur de sondage de 5,2 ± 1,5 mm à 3,9 ± 1,2 mm à 1 an (différence significative entre la situation initiale et après traitement, mais différence non significative entre le groupe implantoplastie et sans implantoplastie) mais un pourcentage de BOP stable de 88,9 % initialement à 88,5 % à 1 an (différence non significative) [38].
- Ramanauskaite et coll. ont trouvé une réduction de la PPS et du BOP respectivement de 2,20 ± 2,22 mm et 60,64 ± 40,81 % lors de chirurgies résectrices, et de 1,57 ± 1,54 mm et 77,45 ± 30,92 % lors de chirurgies combinées [40].
- Schwarz et coll. [52], dans une étude avec réentrée chirurgicale, rendent compte de la cicatrisation de défauts osseux après une thérapie chirurgicale combinée résective/régénérative sur 5 implants après des périodes de cicatrisation de 8 mois à 6,5 ans. Ils ont montré un comblement osseux moyen de 59,4 % ± 47,59 %.
- Englezos et coll. concluent à une réduction des PPS de 8,7 mm en moyenne initialement à 3,3 mm à 2 ans, une résolution du BOP pour 75 % des implants, un niveau osseux stable pour 92,5 % des implants mais avec une récession moyenne de 2 mm [41].
Série de cas n < 30 (tableau 4)
- Thierbach et coll. ont montré une diminution significative des PPS (3,6 ± 1,6 mm), du NAC (1,79 ± 0,36 mm) et du BOP (85,91 ± 11,53 %) dans le groupe traité par implantoplastie (17 implants) [53].
- À un an, Matarasso et coll. trouvent des réductions significatives des PPS (de 8,1 ± 1,8 mm initialement à 4,0 ± 1,3 mm à 1 an), une diminution de la perte osseuse (de 8,0 ± 3,7 mm à 5,2 ± 2,2 mm) avec un comblement osseux de 93,3 ± 13,0 % dans une série de cas sur 11 implants [42].
- Nart et coll. montrent également une diminution significative des PPS et du BOP et une augmentation significative de la hauteur de récession postopératoire [43].
- Sapata et coll. trouvent une réduction significative des indices de saignement (de 88,9 % initialement à 8,3 % à 2 ans) et des indices de plaque 2 ans après implantoplastie (2 implants) [46].
- Galarraga et coll. montrent, dans une série de cas sur 28 implants traités par implantoplastie, une contraction tissulaire de 18,5 % 6 mois après implantoplastie, cette valeur étant en corrélation avec la hauteur de tissu kératinisé initiale [54].
- Afin de diminuer les conséquences esthétiques, Schwarz et coll. ont publié 10 cas traités par implantoplastie, décontamination de surface avec du sérum physiologique et xénogreffe recouverte par une membrane de collagène et une greffe de tissu conjonctif. Ils ont montré une réduction significative de la PPS (2,53 ± 1,80 mm), de la perte d’attache clinique (2,07 ± 1,93 mm), du BOP (74,39 ± 28,52 %) et augmentation de la hauteur moyenne de la muqueuse vestibulaire (0,07 ± 0,5 mm) avec un suivi de 6 mois [55].
Ils ont associé également à l’implantoplastie une matrice collagénique pour traiter un cas (1 implant) et ils ont observé à 1 an une récession de 1,0 ± 0,4 mm et une perte de tissu kératinisé de 1,3 ± 0,5 mm, mais un retour aux valeurs de base respectives après 36 mois de cicatrisation [55].
- Geremias et coll. [56] montrent une diminution de la croissance planctonique moyenne de Streptococcus mutans de 0,15 nm avec la procédure d’implantoplastie.
Conclusion
Sur la base des données disponibles dans cette revue de la littérature, l’implantoplastie semble donner des résultats cliniques et radiographiques positifs, c’est-à-dire une diminution des indices de saignement et de la PPS, une augmentation des niveaux d’attaches cliniques, et une augmentation ou une stabilisation du niveau osseux à court et moyen termes.
Les tableaux 3 et 4 résument les paramètres cliniques obtenus après implantoplastie par niveau de preuve.
Tableau 4. Résultats des études cliniques non randomisées sur les paramètres cliniques après procédure d’implantoplastie. Données brutes issues des publications
|
Étude Type d’étude |
Détails de la population : a. Nombre de patients b. Procédure c. Nombre d’implants avec implantoplastie d. Nombre d’implants sans implantoplastie e. Durée du suivi |
Diminution de la profondeur de poche |
Diminution des saignements et/ou suppurations au sondage |
Niveau d’attache |
Niveau osseux |
Comblement osseux |
Récession |
Indice de plaque |
Hauteur de tissu kératinisé |
Microbiologie |
Échelle de Newcastle-Ottawa [31] |
|
|
Ravidà et coll. (2020) [38] Rétrospective |
a. 41 b. Résectrice c. 30 d. 38 e. 1 an |
De 5,2 ± 1,5 mm (initial) à 3,9 ± 1,2 mm (1 an) |
De 88,9 % (initial) à 88,5 % (1 an) |
– |
3,6 ± 1,1 mm (initial) à 4,3 ± 1,5 mm (1 an) |
– |
– |
– |
– |
– |
6 |
|
|
Ramanauskaite et coll. (2018) [40] Série de cas rétrospective |
a. 39 b. Combinée et résectrice c. 57 d. 0 e. 6 à 126 mois (moyenne de 42 mois) |
Résectrice : 2,20 ± 2,22 mm Combinée : 1,57 ± 1,54 mm |
Résectrice : 60,64 ± 40,81 % Combinée : 77,45 ± 30,92 % |
– |
– |
– |
– |
– |
– |
– |
7 |
|
|
Schwarz et coll. (2015) [52] Rétrospective |
a. 5 b. Combinée c. 5 d. 0 e. 8 à 78 mois |
– |
– |
– |
– |
59,4 % ± 47,59 % |
– |
– |
– |
– |
7 |
|
|
Englezos et coll. (2018) [41] Série de cas prospective |
a. 25 b. Résectrice c. 40 d. 0 e. 24 mois |
De 8,7 mm (initial) à 3,3 mm (2 ans) |
25 % des implants montrent un saignement au sondage à 2 ans et 2,5 % un exsudat purulent à 2 ans |
– |
Niveau osseux stable pour 92,5 % des implants |
– |
Augmentation moyenne de 2,5 mm |
– |
– |
– |
6 |
|
|
Thierbach et coll. (2013) [53] Série de cas prospective |
a. 28 b. Combinée c. 17 d. 33 e. 3 mois |
3,6 ± 1,6 mm |
85,91 ± 11,53 % |
1,79 ± 0,36 mm |
– |
– |
– |
– |
– |
aMMP-8 : diminution de 162,89 ± 111,82 ng/mL |
7 |
|
|
Schwarz et coll. (2014a) [55] Série de cas prospective |
a. 10 b. Combinée c. 13 d. 0 e. 6 mois |
2,53 ± 1,80 mm |
74,39 ± 28,52 % |
2,07 ± 1,93 mm |
– |
– |
Diminution de la hauteur de récession vestibulaire de 0,07 ± 0,5 mm Augmentation de la récession (en 6 points) de 0,46 ± 0,77 mm |
De 0,23 ± 0,59 (initial) à 0,0 ± 0,0 (6 mois) |
– |
– |
4 |
|
|
Matarasso et coll. (2014) [42] Série de cas prospective |
a. 11 b. Combinée c. 11 d. 0 e. 12 mois |
De 8,1 ± 1,8 mm (initial) à 4,0 ± 1,3 mm (1 an) |
Saignement au sondage : de 19,7 ± 40,1 % (initial) à 6,1 ± 24 % (1 an) Score de saignement total : de 7 ± 3,5 (initial) à 6,2 ± 2,5 (1 an) |
De 9,7 ± 2,5 mm (initial) à 6,7 ± 2,5 mm (1 an) |
De 8,0 ± 3,7 mm (initial) à 5,2 ± 2,2 mm (1 an) |
93,3 ± 13,0 % |
Augmentation de 1,7 ± 1,5 mm (initial) à 3,0 ± 1,8 mm (1 an) |
Score plaque total : de 9,7 ± 2,5 (initial) à 8,9 ± 2,9 (1 an) |
– |
– |
6 |
|
|
Nart et coll. (2018) [43] Série de cas prospective |
a. 13 b. Combinée c. 17 d. 0 e. 12 mois |
4,23 ± 1,47 mm |
70,6 % |
– |
Réduction du défaut osseux de 0,56 ± 0,88 mm |
86,99 ± 18,2 % |
Augmentation moyenne de 1,31 ± 0,47 mm |
Indice de plaque total : de 18 % (initial) à 25 % (1 an) |
– |
– |
6 |
|
|
Bianchini et coll. (2020) [44] Série de cas prospective |
a. 4 b. Résectrice c. 4 d. 0 e. 3 ans |
4,75 ± 1 mm |
71 % |
– |
Stable dans 100 % des cas Mésial : réduction de 0,8 ± 0,5 mm Distal : réduction de 0,5 ± 0,3 mm |
– |
– |
– |
– |
– |
6 |
|
|
Galarraga-Vinueza et coll. (2020) [54] Série de cas prospective |
a. 20 b. Combinée c. 28 d. 0 e. 6 mois |
1,26 ± 1 mm |
49 % |
– |
– |
– |
Augmentation de 0,61 ± 0,4 mm Contraction tissulaire de 18,5 % à 6 mois |
Indice de plaque diminué de 0,05 ± 0,5 |
Diminution de 1,4 ± 1 mm |
– |
5 |
|
|
Schwarz et coll. (2014b) [59] Rapport de cas |
a. 1 b. Combinée c. 1 d. 0 e. 36 mois |
4,3 ± 0,5 mm |
100 % |
4,4 ± 0,4 mm |
– |
– |
0 |
0 |
= hauteur initiale |
– |
6 |
|
|
Sapata et coll. (2016) [46] Rapport de cas |
a. 1 b. Résectrice c. 2 d. 4 e. 24 mois |
– |
Indice de saignement modifié : de 88,9 % (initial) à 8,3 % (2 ans) |
– |
– |
– |
– |
Indice de plaque global : de 83,3 % (initial) à 12,5 % (2 ans) |
– |
– |
2 |
|
|
Geremias et coll. (2017) [56] Rapport de cas |
a. 1 b. Résectrice c. 1 d. 2 e. 4 mois |
– |
– |
– |
– |
– |
– |
– |
– |
Diminution de la croissance planctonique moyenne de Streptococcus mutans de 0,15 nm |
5 |
Discussion
Justification de la méthode
La présente revue systématique de la littérature s’intéresse aux résultats cliniques suite à la procédure d’implantoplastie.
En rapport avec un nombre restreint d’études cliniques sur l’implantoplastie, le choix a été fait de sélectionner tous les types d’études cliniques traitant de ce sujet. Afin de ne pas mettre les études sur un même niveau de preuve, elles ont été présentées par niveau de preuve en commençant par les études cliniques randomisées jusqu’aux rapports de cas. Les essais cliniques randomisés sont difficiles à mettre en œuvre et cette revue de la littérature n’en comprend que 9. L’ajout des séries de cas a été motivé pour des raisons cliniques, pour présenter un état actuel de la question et bénéficier de l’expérience clinique des auteurs, même au travers de rapports de cas. Le but étant de rechercher un protocole clinique opératoire reproductible et facile d’emploi pour soigner les péri-implantites de manière fiable et pérenne. L’implantoplastie semble avoir un impact positif sur le taux de survie, les paramètres cliniques et radiologiques, et ajoute un bénéfice potentiel au traitement des péri-implantites.
Cependant, la définition des paramètres de succès influence largement les résultats obtenus. Les taux de survie sont élevés jusqu’à 100 % à 3 ans pour Roméo et coll. [35], 100 % à 3 ans pour Dalago et coll. [36], 87 % à 9 ans pour Pommer et coll. [37], 90 % Pour Ravidà et coll. [38] à 1 an, 87 % pour Bianchini et coll. [39] sur 3,4 ans en moyenne. D’autres séries de cas ou rapports de cas montrent des taux de survie de 100 % : Englezos et coll. [41], Matarasso et coll. [42], Nart et coll. [43], Bianchini et coll. [44], Galarraga-Vinueza et coll. [54], Sapata et coll. [46], Austoni et coll. [45], Suh et coll. [27].
En revanche, si l’on prend en compte des critères plus stricts de santé péri-implantaire ou de résolution de la maladie (taux de succès thérapeutique), des résultats moins performants sont obtenus : 15 % des implants pour Lasserre et coll. [33], 62,5 % pour Dalago et coll. [36], 33 % des implants (25 % pour le groupe résectrice, 56,3 % pour le groupe avec technique combinée) pour Ramanauskaite et coll. [40], 33 % également pour Bianchini et coll. [39] et Ravidà et coll. [38] (33 % selon les critères de Berglundh et coll. [14] ; 36,8 % selon ceux de Bianchini et coll. [36]).
Comparaison des résultats
La procédure d’implantoplastie permet une diminution significative de la PPS de 5,78 mm (initial) à 3,21 mm (36 mois) pour Romeo et coll. [34], de 0,74 ± 1,89 mm (groupe laser) et 2,55 ± 1,67 mm (groupe curettes et sérum physiologique) à 7 ans pour Schwarz et coll. [50], de 6,38 ± 0,53 mm (initial) à 4,13 ± 0,40 mm (3 ans) pour Dalago et coll. [36], de 6,72 1,78 mm (initial) à 2,73 ± 1,59 mm (6 mois) pour Lasserre et coll. [33], de 2,65 ± 2,14 mm (groupe laser) versus 1,85 ± 1,71 mm (groupe sans laser) à 6 mois pour Wang et coll. [51], de 5,2 ± 1,5 mm (initial) à 3,9 ± 1,2 mm (1 an) pour Ravidà et coll. [38], de 2,20 ± 2,22 mm (chirurgie résectrice) et 1,57 ± 1,54 mm (chirurgie combinée) sur une moyenne de 42 mois pour Ramanauskaite et coll. [40], de 8,7 mm (initial) à 3,3 mm (2 ans) pour Englezos et coll. [41], de 3,6 ± 1,6 mm à 3 mois pour Thierbach et coll. [53], de 2,53 ± 1,80 mm à 6 mois pour Schwarz et coll. [55], de 8,1 ± 1,8 mm (initial) à 4,0 ± 1,3 mm (1 an) pour Matarasso et coll. [42], de 4,23 ± 1,47 mm à 1 an pour Nart et coll. [43], de 4,75 ± 1 mm pour Bianchini et coll. [44] à 3 ans, de 1,26 ± 1 mm à 6 mois pour Galarraga-Vinueza et coll. [54], de 4,3 ± 0,5 mm à 6 mois pour Schwarz et coll. [55].
En comparaison avec des études n’utilisant pas d’implantoplastie, Roccuzzo et coll. [57] montrent une diminution de la PPS de 2,1 ± 1,2 mm sur des implants à état de surface TPS (la même que celle de l’étude de Romeo et coll. [34]) avec un Ra = 3,1 mm [58] et de 3,4 ± 1,7 mm sur surface SLA à 1 an. Cette étude conclut que les caractéristiques de l’état de surface peuvent avoir un impact sur le résultat clinique suite à un débridement chirurgical de péri-implantite.
L’implantoplastie permet également de diminuer les signes cliniques inflammatoires, caractéristiques des maladies péri-implantaires : l’indice de saignement diminue de 2,83 (initial) à 0,61 (36 mois) pour Romeo et coll. [34], le BOP de 86,66 ± 18,26 % (groupe laser) versus 89,99 ± 11,65 % (groupe curettes et sérum physiologique) à 7 ans pour Schwarz et coll. [50], de 4,5 ± 0,57 % (initial) à 1,25 ± 0,53 % (3 ans) pour Dalago et coll. [36], de 94,7 ± 10,7 % (initial) à 33,3 ± 24,2 % (6 mois) pour Lasserre et coll. [33], de 0,31 ± 0,62 (groupe laser) et de 0,39 ± 0,55 (groupe contrôle) à 6 mois pour Wang et coll. [51], de 88,9 % (initial) à 88,5 % (1 an) pour Ravidà et coll. [38], de 60,64 ± 40,81 % (chirurgie résectrice) et 77,45 ± 30,92 % (chirurgie combinée) pour Ramanauskaite et coll. [40] sur une moyenne de 42 mois, Englezos et coll. [41] montrent qu’il persiste uniquement 25 % des implants avec un BOP à 2 ans, une diminution du BOP de 85,91 ± 11,53 % à 3 mois pour Thierbach et coll. [53], de 74,39 ± 28,52 % pour Schwarz et coll. [55] à 6 mois, de 19,7 ± 40,1 % (initial) à 6,1 ± 24 % (1 an) pour Matarasso et coll. [42], de 70,6 % à 1 an pour Nart et coll. [43], de 71 % à 3 ans pour Bianchini et coll. [39], de 49 % à 6 mois pour Galarraga-Vinueza et coll. [54], de 100 % pour Schwarz et coll. [59] à 3 ans, une diminution de l’indice de saignement modifié de 88,9 % (initial) à 8,3 % (2 ans) pour Sapata et coll. [46].
En comparaison avec des études sans implantoplastie, Heitz-Mayfield et coll. [60] montrent une résolution de l’inflammation (BOP négatif) pour 47 % des implants à 1 an.
La modification du revêtement implantaire permet également de bons résultats radiologiques concernant le niveau osseux. Les résultats obtenus dépendent du type de procédure chirurgicale : un niveau osseux stable en cas de procédure résectrice et un comblement du défaut osseux en cas de procédure régénératrice. Roméo et coll. [35] montrent un niveau osseux stable à 3 ans, Schwarz et coll. [50] un gain osseux de 1,36 ± 1,04 mm (groupe laser) versus 0,49 ± 0,92 mm (groupe curettes et sérum physiologique), un niveau osseux de 5,53 ± 0,57 mm (initial) à 6,39 ± 0,58 mm (3 ans) pour Dalago et coll. [36], de 4,73 ± 2,67 mm (initial) à 4,47 ± 3,06 mm (6 mois) pour Lasserre et coll. [33], une diminution du défaut osseux de 24,46 ± 19 % (groupe laser) versus 15,19 ± 23,56 (groupe contrôle) à 6 mois pour Wang et coll. [51], un niveau osseux de 3,6 ± 1,1 mm (initial) à 4,3 ± 1,5 mm (1 an) pour Ravidà et coll., un comblement osseux de 59,4 ± 47,59 % pour Schwarz et coll. [52], un niveau osseux stable pour 92,5 % des implants pour Englezos et coll. [41] à 2 ans, un comblement osseux de 93,3 ± 13,0 % pour Matarasso et coll. [42] à 1 an, de 86,99 ± 18,2 % pour Nart et coll. [43] à 1 an.
En comparaison avec une procédure sans implantoplastie, Wiltfang et coll. [61] montrent une réduction des défauts osseux de 3,5 mm en moyenne avec une procédure régénératrice à 1 an.
En ce qui concerne les récessions, Romeo et coll. [34] trouvent une augmentation de la récession de 0,5 mm (initial) à 1,96 mm (24 mois), de 1,36 ± 1,04 mm (groupe laser) versus 0,49 ± 0,92 mm (groupe curettes et sérum physiologique) à 7 ans pour Schwarz et coll. [55], de 0,23 ± 0,48 mm (initial) à 0,75 ± 0,71 mm (6 mois) pour Dalago et coll. [36], de 2,5 mm à 2 ans pour Englezos et coll. [41], de 1,7 ± 1,5 mm (initial) à 3,0 ± 1,8 mm (1 an) pour Matarasso et coll. [42], de 1,31 ± 0,47 mm à 1 an pour Nart et coll. [43], de 0,61 ± 0,4 mm avec une contraction tissulaire de 18,5 % à 6 mois pour Galarraga-Vinueza et coll. [54].
Il est donc indispensable de prévenir le patient du risque de récession postopératoire. Pour autant, cette dernière peut être diminuée avec l’utilisation de greffe de tissu conjonctif (récession vestibulaire de 0,07 ± 0,5 mm à 6 mois pour Schwarz et coll. [55]) ou de matrice collagénique (niveau stable à 36 mois pour Schwarz et coll. [59]).
Seuls Geremias et coll. [56] et Thierbach et coll. [53] ont évalué des paramètres microbiologiques et trouvent une amélioration de ces paramètres grâce à l’implantoplastie.
La majorité des études montrent un taux de survie satisfaisant et une amélioration des paramètres cliniques et radiologiques. Pour les futures recherches, il est conseillé aux praticiens l’enregistrement des paramètres cliniques et radiologiques les plus utilisés et qui permettent une comparaison entre les études (taux de succès avec des critères stricts de santé péri-implantaire, taux de survie, diminution de la PPS, du niveau d’attache, du BOP, la récession, le niveau osseux, le pourcentage de comblement osseux) avant et après les traitements chirurgicaux de péri-implantites sur de grandes séries de cas prospectives à long terme (minimum 1 an) et sur des populations comparables (score de plaque, compliance). Ces études sont plus faciles à mettre en œuvre que les essais randomisés et permettraient de traiter un nombre important d’implants et d’évaluer les bénéfices de la procédure pour les patients.
Les limites de l’étude
Les études comparatives pour montrer la méthode de décontamination la plus efficace sont encore peu concluantes. Une grande hétérogénéité et de nombreuses disparités ont été observées entre les études sur le nombre de cas (de 1 à 70), la durée de suivi (de 3 mois à 9 ans), les critères de succès (succès strict ou survie implantaire), les paramètres cliniques et une variété de scores différents pour les mesurer, la manière de mesurer les résultats radiologiques (millimètre ou pourcentage), leur puissance (essai clinique randomisé ou rapport de cas), etc. De plus, les protocoles chirurgicaux sont très différents : chirurgie résectrice, chirurgie régénératrice, méthodes de décontamination complémentaires, antibiothérapie, critères d’inclusions (certains cas très sévères et d’autres moins ; les résultats obtenus peuvent donc être disparates).
L’analyse de la littérature concernant ces différents protocoles devrait permettre de préciser le matériel et les méthodes chirurgicales les plus adaptées aux différentes situations cliniques : zone esthétique ou non, accessibilité chirurgicale, type de lésion.
Sur la base de cette revue systématique de la littérature, il est possible d’émettre l’hypothèse que l’implantoplastie semble associée à de bons résultats en termes de survie implantaire, de diminution de BOP, de la PPS et d’absence de perte osseuse évolutive.
Pertinence clinique
Rationnel scientifique de l’étude
Le traitement des péri-implantites constitue un challenge thérapeutique alors que leur prévalence ne cesse d’augmenter. Les praticiens doivent trouver une méthode fiable de prise en charge des pathologies péri-implantaires.
Conclusions principales
La littérature montre que l’implantoplastie permet d’obtenir un taux de survie implantaire satisfaisant et d’améliorer les paramètres cliniques et radiologiques.
Implications cliniques
La procédure d’implantoplastie peut être utilisée lors du traitement chirurgical des péri-implantites afin de soigner ou de maintenir les implants.










Commentaires