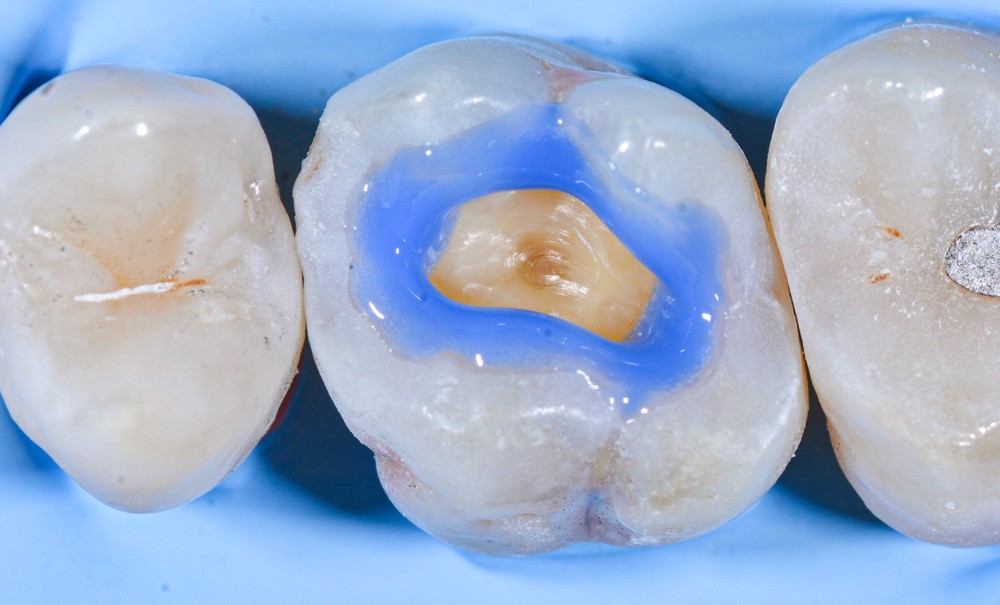
Les systèmes adhésifs amélo-dentinaires sont des biomatériaux d’interfaces. Ils contribuent à former le joint collé, c’est-à-dire un lien idéalement adhérent et étanche ente les tissus dentaires calcifiés et des biomatériaux dentaires de restauration (composites de restauration) ou d’assemblage (colles ou composites de collage). Leur apport à l’essor de théra–peutiques esthétiques, conservatrices et biocompatibles est tellement évident que leur utilisation ne se discute plus. Comment imaginer, aujourd’hui, des soins restaurateurs, prothétiques, orthodontiques ou pédodontiques sans les techniques adhésives ? Si la preuve de l’efficacité clinique des techniques adhésives n’est plus à faire [1], il n’en demeure pas moins que de nombreux travaux de recherche sont en cours pour tenter de mieux comprendre les mécanismes d’adhésion aux tissus dentaires calcifiés et améliorer encore la qualité et la longévité des restaurations. En effet, si le collage à l’émail n’est plus un problème depuis longtemps, le collage à la dentine est une opération qui demeure délicate. L’interphase dentine-adhésif apparaît souvent imparfaite. Cela concourt à la dégradation progressive du joint collé. Actuellement, nous entrons dans une nouvelle ère en dentisterie adhésive, où l’émail et la dentine commencent à être compris à l’échelle nanoscopique. Le but de cette compréhension est de pouvoir améliorer la pérennité clinique de l’interface adhésif-dent grâce aux nouvelles découvertes faites dans la technologie adhésive (fig. 1).
L’objectif de cet article est d’examiner les processus fondamentaux responsables des mécanismes de vieillissement et de dégradation du joint collé au niveau de l’interface adhésif/dent, puis de présenter les approches pour prévenir et contrer cette dégradation.
Formation du joint collé : rappel
Après fraisage, les surfaces d’une préparation sont recouvertes d’une couche de boue formée des débris d’usinage. En anglais, elle est appelée smear layer. Cette couche poreuse et hétérogène est un agglomérat d’hydroxyapatite et de protéines. Elle contient également des bactéries. Son épaisseur est variable selon la granularité des instruments rotatifs employés. Elle est d’1 µm après préparation avec des fraises ultrafines et peut atteindre 2,8 µm avec des instruments à gros grains [2]. Quel que soit le système adhésif, la procédure de collage commence par un traitement acide pour l’éliminer ou la stabiliser. Ce traitement acide affecte, au-delà de cette couche, la surface de l’émail et de la dentine pour créer des microrugosités propices à l’infiltration de monomères qui, après polymérisation, formeront une interphase adhérente et idéalement étanche entre les tissus dentaires et le biomatériau de restauration. Schématiquement, il s’agit de substituer de la résine à l’hydroxyapatite déminéralisée ou éliminée. La principale composante de l’adhésion aux tissus dentaires est donc principalement micromécanique. Toutefois, des interactions chimiques additionnelles peuvent contribuer également à la liaison lorsque l’adhésif contient certains monomères fonctionnels capables de s’unir notamment à l’hydroxyapatite [3]. Cette composante chimique, dont l’effet à court terme est masqué par la ténacité de l’ancrage micromécanique, pourrait jouer un rôle non négligeable dans le potentiel d’adhérence de certains adhésifs et dans la longévité des joints collé (fig. 2).
Deux approches stratégiques peuvent être utilisées pour l’adhésion aux tissus dentaires :
1re stratégie : création des microrugosités, puis infiltration par la résine adhésive. Cette stratégie se caractérise par une déminéralisation forte à l’acide orthophosphorique et une élimination des boues, c’est-à-dire des substances de l’attaque acide. Cette approche est obtenue avec des adhésifs de type M&R (ou avec un Universal utilisé avec prémordançage à l’acide phosphorique).
2e stratégie : création des microrugosités et infiltration par la résine adhésive simultanément. Cette stratégie se caractérise par une déminéralisation faible et une conservation des boues. Cette approche est obtenue avec des adhésifs de type SAM (ou avec un Universal utilisé sans prémordançage à l’acide phosphorique).
Rappel sur la notion de couche hybride
La couche hybride est un entrelacement de deux types de polymères : les fibres de collagène de la matrice dentinaire, polymère d’origine naturelle d’une part, et les macromolécules de l’adhésif, polymères de synthèse d’autre part. L’imprégnation des protéines dentinaires par la résine rend la couche hybride acido-résistante [4]. Une zone hybride de bonne qualité, non dégradable, pourrait être une protection de la dentine intacte sous-jacente et se révéler potentiellement cario-résistante. En pratique, cet idéal n’existe pas encore.
Les brides résineuses intracanaliculaires (ex. : résine adhésive ayant polymérisé à l’intérieur des canalicules dentinaires) participent, comme la couche hybride, à l’adhésion dentinaire sans que l’on puisse dire lequel des deux phénomènes est dominant. On peut supposer que ces brides de résine jouent un rôle pour les cavités profondes, compte tenu de l’augmentation de la densité et du diamètre des tubules au fur et à mesure que l’on se rapproche de la pulpe [5]. Mais l’élimination des boues dentinaires conduit à une perfusion continue de fluide dentinaire vers la surface sous l’effet de la pression intrapulpaire. Ce flux centrifuge est plus important en dentine profonde pour les raisons anatomiques évoquées. L’impossibilité d’éliminer l’eau résiduelle affaiblit nécessairement le joint collé.
Dégradation de l’interface dent/adhésif
Généralités
La formation d’un joint réellement étanche au contact de la dent reste actuellement un problème à résoudre. Cela tient en premier lieu à la complexité des substrats que l’on rencontre en clinique. La surface d’une préparation n’est que rarement constituée d’émail et de dentine primaire saine. Les parois d’une même cavité peuvent être composées de différents types de tissus modifiés : émail hypominéralisé, dentines secondaires, tertiaires, sclérotiques, déminéralisées, reminéralisées ou hyperminéralisées. La spécificité de ces différents états est nécessairement conséquente sur les valeurs d’adhésion et d’étanchéité aux interfaces cavitaires [6].
Différents types de dégradation peuvent être observés au niveau d’un joint collé : les facteurs physiques et chimiques agissent surtout sur la partie résineuse du joint collé et sur l’émail dentaire, alors que les facteurs biologiques interviennent essentiellement sur la matrice dentinaire au sein de la couche hybride.
Facteurs physico-chimiques
Hydrolyse
Dégradation par hydrolyse de la partie résineuse
Hashimoto et al. ont décrit deux types de dégradation de la partie résineuse de la couche hybride obtenue avec un adhésif M&R. Après conservation d’échantillons en milieu hydrique pendant un an, ces auteurs décrivent une désorganisation des fibres de collagène et une hydrolyse de la résine contenue dans les espaces inter- fibrillaires au sein de la couche hybride, se caractérisant par une diminution des valeurs d’adhérence dentine/adhésif [7]. Le processus d’hydrolyse, considéré comme le principal facteur de la dégradation de la résine au sein de la couche hybride, se caractérise par une rupture des liaisons covalentes esters unissant les chaînes de polymères résineux [8, 9]. Ce processus concourt à la diminution des valeurs d’adhérence dentine/adhésif au cours du temps [9-15]. Ce processus d’hydrolyse est en relation avec des possibilités d’absorption hydrique constatées avec certains systèmes adhésifs [12, 16, 17]. L’absorption hydrique est à l’origine d’une diminution du module d’élasticité de la résine qui contribue à la réduction des valeurs d’adhérence à la dentine, indépendamment du processus d’hydrolyse de la résine [17]. Même si la pénétration de l’adhésif peut, dans certains cas, apparaître matériellement complète, la qualité de l’hybridation n’est pas nécessairement bonne. La zone de dentine déminéralisée peut n’être que partiellement infiltrée par les monomères [18]. Avec les adhésifs de type M&R, on observe un différentiel entre l’épaisseur de tissu déminéralisé et l’épaisseur de l’infiltration de la résine. Cela se traduit par des défauts à la base de la couche hybride, source de nano-fuites (ou nano-porosité) [19, 20]. Les adhésifs de type SAM contiennent une grande quantité de monomères hydrophiles en comparaison avec les adhésifs de type M&R [21], ce qui leur confère un grand degré de perméabilité après polymérisation. La couche hybride et la couche de résine sus-jacente se comportent alors comme une membrane semi- perméable qui permet des mouvements hydriques au sein de l’interface dentine/adhésif [22]. Des études menées ont permis d’objectiver deux modes de nano-porosités : un mode réticulé et un mode punctiforme [23, 24]. Le mode réticulé se caractérise morphologiquement par une arborescence de zone hydrique [23, 24] ; le mode punctiforme observé à l’intérieur de la couche de résine se caractérise par des microdomaines de résine composés de groupes fonctionnels hydrophiles et/ou acides entourés par des domaines adjacents plus hydro-phobes [23, 25]. À l’intérieur de ces porosités, les mouvements hydriques sont régis par des mécanismes de diffusion qui de-viennent de plus en plus importants à l’intérieur de ces canaux hydriques [15, 26]. La deuxième cause des mouvements hydriques est liée à un gradient de pression osmotique induit par la haute concentration des ions inorganiques et de résidus de monomères hydrophiles qui sont contenus dans les réserves d’eau sous la couche hybride [27, 28]. Tous ces mécanismes de mouvement hydrique favorisent l’absorption d’eau par la résine et compromettent à long terme l’intégrité de l’adhésion composite/adhésif. La dentine est composée de protéines collagéniques et non collagéniques. Parmi celles-ci, les protéoglycanes semblent jouer un rôle fondamental. En effet, ils stabilisent l’arrangement des fibres de collagène [29, 30]. La présence de chondroïtines 4 et 6 sulfates est d’ailleurs parfaitement décrite dans la pré-dentine, la dentine et le cément [29, 30] comme intervenant dans la régulation de l’arrangement tridimensionnel final des fibres de collagène. En d’autres termes, les protéoglycanes sont responsables de l’apparence tridimensionnelle de la matrice organique de dentine en intervenant sur le remplissage des espaces, sur la liaison et l’organisation des molécules d’eau et en attirant les molécules chargées négativement [31-34]. Ainsi, les protéoglycanes peuvent influencer l’affinité de l’eau pour le collagène dans la couche hybride en régulant les phénomènes de substitution hydrique qui interviennent pendant la formation de la couche hybride [35] (fig. 3 et 4). Des études ont montré que le réseau de collagène associé à ses protéoglycanes jouait le rôle de filtre sélectif conduisant à des séparations de phase de l’adhésif [36, 37]. Les monomètres de poids moléculaire élevé et à caractère hydrophobe ne pénètrent que superficiellement la matrice protéique. À l’inverse, les monomères hydrophiles à bas poids moléculaire (type HEMA) constituent l’essentiel de la zone d’infiltration profonde. L’imprégnation du collagène à ce niveau est faite par une résine de mauvaise qualité, peu polymérisée et susceptible de s’hydrolyser dans le temps. En effet, ces zones de mauvaise polymérisation constituent là encore une source d’eau à l’origine du processus d’hydrolyse.
Dégradation par hydrolyse de la partie collagénique
Le collagène, qui n’est plus protégé par une gaine de résine en relation avec les phénomènes d’hydrolyse (voir paragraphe précédent), peut à son tour être le siège de dégradation par un processus d’hydrolyse. Plusieurs études ont mis en évidence ce processus de dégradation hydrique des fibres de collagène au cours du temps [38-43].
Autres facteurs physico-chimiques
Des facteurs physiques comme les forces occlusales ou le stress lié aux variations dimensionnels en relation avec les variations de température de la cavité buccale [44] affectent la stabilité de l’interphase dent/adhésif [45, 46].
De plus, pendant sa polymérisation, la résine composite se contracte entre 1,5 à 5 % en volume [47]. Cette contraction de prise peut être à l’origine de déchirures plus ou moins étendues et profondes au niveau du joint collé avec la création de hiatus et de percolation. Ce phénomène a une action sur l’étanchéité immédiate et par conséquent sur l’étanchéité retardée du joint et sur sa dégradation dans le temps.
Les agents chimiques acides contenus dans la salive, le fluide dentinaire, l’alimentation, les boissons et les produits bactériens interviennent sur l’interface dent/biomatériaux et dégradent les fibres de collagène [26, 38- 41] et les composants résineux par dissolution ou en initiant la survenue de lésion carieuse au niveau du joint collé [25, 38, 46].
Facteurs biologiques
Les fibres de collagène peuvent être le siège d’une dégradation par l’action protéolytique d’enzymes d’origine bactérienne, salivaire et endogène [48-54].
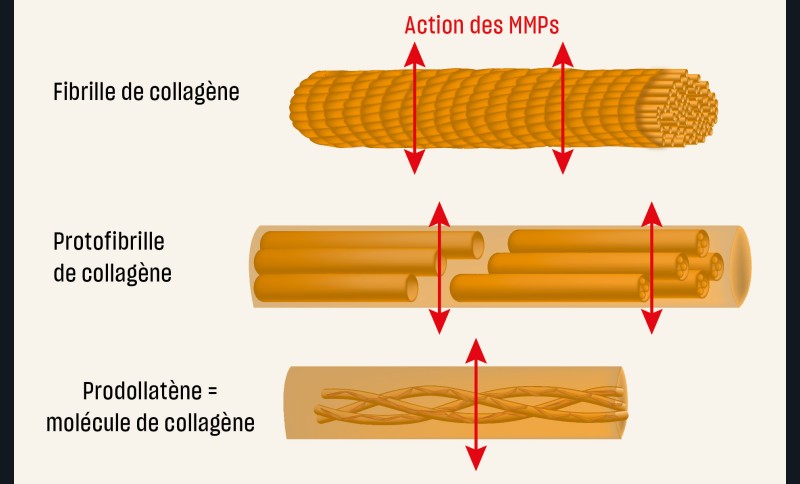
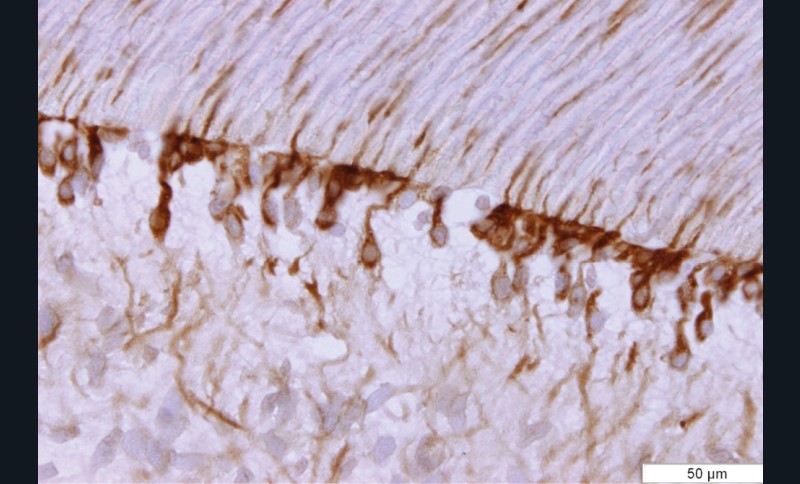
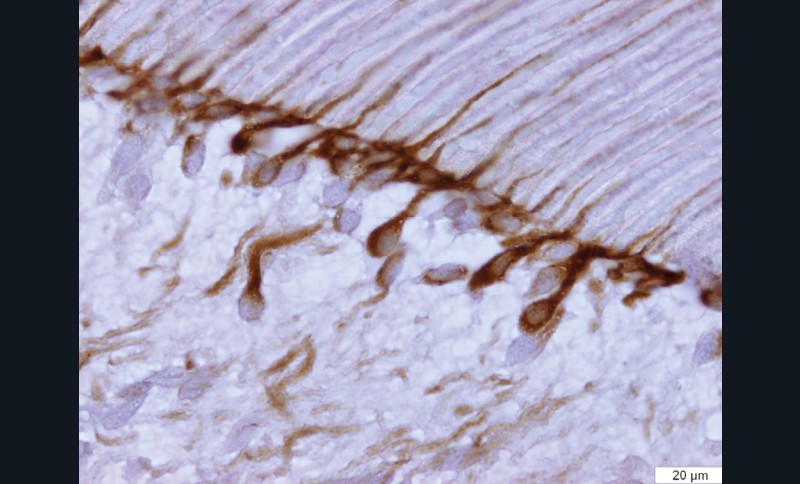
Des études ont démontré la responsabilité des métalloprotéases (MMPs) endogènes sur la dégradation des fibres de collagènes, mal imprégnées de résine, au sein de la couche hybride [39, 48- 53]. Les MMPs sont des enzymes intervenant dans le métabolisme de certains composants de la matrice extra-cellulaire. Dans le domaine odontologique, ces enzymes sont particulièrement connues pour leur implication dans la dégradation de la matrice dentinaire au cours du processus carieux [55]. Les MMPs mettent en péril l’adhésion et l’étanchéité des restaurations et influencent donc directement la pérennité des thérapeutiques adhésives (fig. 5).
L’utilisation d’un adhésif M&R sur la dentine peut potentialiser la voie de dégradation du collagène. En effet, l’acide orthophosphorique utilisé avec les systèmes adhésifs M&R élimine l’hydroxyapatite de la dentine, protection naturelle du collagène. Le collagène peut alors être le siège de dégradation par un processus d’hydrolyse [38, 39, 40, 41] et par un processus protéolytique comme évoqué précédemment [48-52, 54].
Par ailleurs, la capacité des systèmes adhésifs amélo-dentinaires à induire une augmentation de proMMP-9, proMMP-2 et MMP-2 dans le complexe pulpo-dentinaire ainsi qu’une augmentation significative de l’expression de MMP-2 au sein des odontoblastes [56] (fig. 6 et 7) ont été mis en évidence in vitro et ex vivo. Deux hypothèses ont été proposées par ces auteurs pour expliquer cette activation [56] : la première correspond à celle déjà utilisée pour expliquer les réactions dentinogénétiques sous lésion carieuse. La déminéralisation acide de la dentine par les systèmes adhésifs permettrait la solubilisation de certains facteurs de croissance (tels que TGF-β1, -2, -3, BMPs, IGF-I, -II, PDGF) [57- 59]. Celle-ci serait suivie de la diffusion intratubulaire des facteurs en direction du tissu pulpaire et de la stimulation des cellules odontoblastiques et pulpaires périphériques situées à l’extrémité interne des tubules. Cette hypothèse est renforcée par plusieurs études qui ont démontré que l’expression des MMPs était régulée par TGF-β1 et certaines BMPs (Bone morpho protein) [60, 61]. La seconde hypothèse serait que des résidus de monomères acides non ou mal polymérisés ou des protons issus de l’ionisation des monomères pourraient diffuser à travers les tubuli dentinaires et créer un environnement acide à proximité des odontoblastes. Les odontoblastes ont la capacité d’exprimer des canaux ioniques pH sensibles [62]. Ainsi, une modification de l’activité de ces canaux pourrait participer à la régulation de l’expression des MMPs par les odontoblastes.
Prévention de la dégradation du joint collé
Il faut noter qu’aucune des propositions actuelles ne permet d’éviter la dégradation du joint collé, mais uniquement de la retarder.
Utilisation d’inhibiteurs des MMP
Utilisation de chlorhexidine
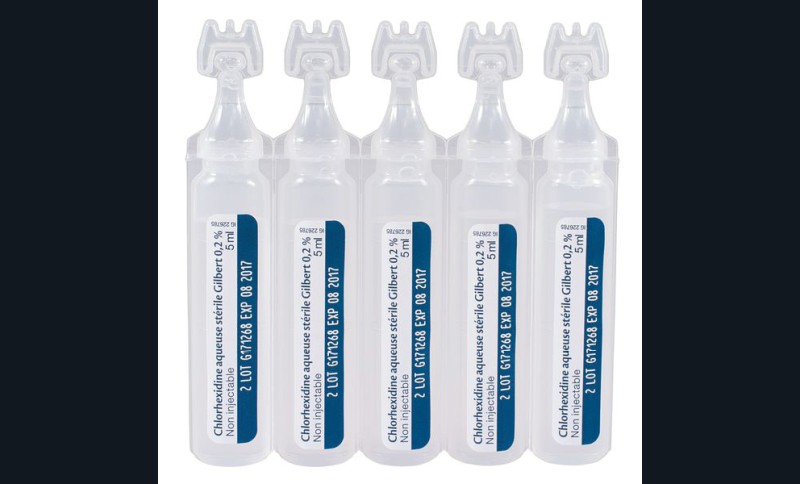
La chlorhexidine, un puissant agent antimicrobien, inhibe efficacement les MMP-2, -8 et -9, et les cathepsines [63]. En 2004, une première étude a démontré de façon convaincante son efficacité à inhiber l’activité collagénolytique des métalloprotéases dentinaires [48]. La chlorhexidine peut être utilisée selon trois principes : incorporée dans l’agent de mordançage acide qui est ensuite rincé ; incorporée dans l’adhésif ou encore appliquée directement en solution (solution aqueuse de chlorhexidine dont la concentration est comprise entre 0,2 % et 2 %) sur la dentine après mordançage. Précisons que l’application de chlorhexidine en phase aqueuse n’altère pas l’adhérence des systèmes adhésifs. Plusieurs études in vitro et in vivo ont démontré que la chlorhexidine peut préserver l’intégrité du collagène au sein de la couche hybride [64-73] et atténuer les effets du temps sur l’efficacité du collage. Cependant une méta-analyse a montré qu’on pouvait procéder à l’application de chlorhexidine dans les cavités dentaires, afin d’inhiber la dégradation de la couche hybride, mais que les données probantes cliniques à l’appui d’un bénéfice sur la pérennité du joint collée étaient insuffisantes [74]. L’explication la plus probable est que l’inhibition des métalloprotéases n’arrête pas la dégradation du joint collé car la dégradation hydrolytique se poursuit (fig. 8).
Autres inhibiteurs
Noter que des études expérimentales sont en cours pour utiliser d’autres inhibiteurs des métalloprotéases et tenter de les incorporer dans les systèmes adhésifs tels que le galardin, des bisphosphonates, la tétracycline, le glutaraldéhyde et des dérivés des ammoniums quaternaires [63]. Le rapport bénéfice/risque de l’utilisation de telles substances est à ce jour défavorable, ce qui explique leur absence d’utilisation clinique à ce jour.
Privilégier un mordançage sélectif de l’émail
L’avantage principal des adhésifs de type M&R ou d’un Universal utilisé avec un prémordançage à l’acide orthophosphorique est l’obtention d’un ancrage micromécanique fort sur l’émail [75]. Au niveau de l’émail, il est admis que pour obtenir une liaison fiable et pérenne, l’utilisation d’un acide fort comme l’acide phosphorique reste la référence par rapport à l’utilisation d’un acide plus faible contenu dans les SAM [76-79]. Mais l’acide orthophosphorique à l’origine de la force de la stratégie M&R est aussi à l’origine de sa faiblesse. Il est considéré comme trop agressif pour la dentine car il élimine son hydroxyapatite, protection naturelle du collagène. Ce dernier peut alors être le siège de la biodégradation enzymatique et l’hydrolyse comme décrit précédemment [80, 81]. Il faut donc privilégier un mordançage sélectif à l’acide phosphorique uniquement sur l’émail, puis une application d’un adhésif universel sur la dentine et l’émail, c’est-à-dire en mode automordançant (SAM). La déminéralisation de la dentine induite par un acide faible n’est que partielle, mais suffisante pour obtenir un engrènement micromécanique (fig. 9).
Utilisation d’adhésif contenant des monomères fonctionnels
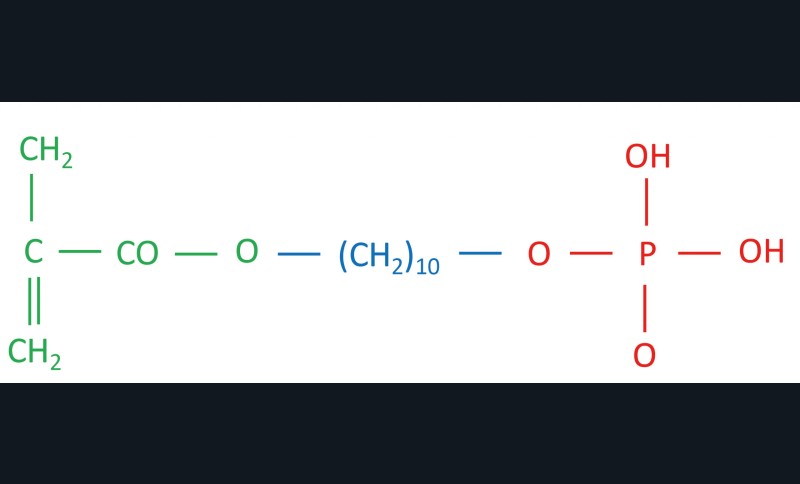
L’utilisation d’adhésif universel contenant un monomère fonctionnel pourrait être intéressante pour le clinicien (ex. : Scotchbond Universal 3M, Adhese Universal Ivoclar, All Bond Universal Bisico, Optibond Universal Kerr, G Premio Bond GC, Clearfil Universal BondQuick Kuraray, Peak Universal Ultradent, Prime & Bond Active Dentsply Sirona, Iperbond Ultra Itena, Solo Bond Plus Voco…). Le principal monomère fonctionnel est le 10-MDP. Ce monomère peut lier des interactions avec le collagène et se lie efficacement à l’hydroxyapatite (liaisons phosphate/calcium) [82]. Parmi les monomères fonctionnels, le 10-MDP semble le plus efficace pour créer des liaisons ioniques fortes avec l’hydroxyapatite, formant ainsi des sels calciques de 10-MDP stables qui contribuent à la durabilité du collage. Mais restons prudents car la pertinence de ces interactions moléculaires sur la pérennité du joint collé n’a pas été clairement prouvée. De plus, rappelons que le 10-MDP est une molécule très sensible à la dégradation par hydrolyse [83].
Le 10-MDP, comme la majorité des monomères fonctionnels, est composé de trois parties (fig. 10) :
- Un groupement méthacrylate polymérisable qui copolymérise avec les autres monomères.
- Un groupement espaceur qui sépare le groupement méthacrylate du groupement fonctionnel acide. La structure chimique du groupement espaceur et sa longueur influencent les capacités d’interactions chimiques avec l’hydroxyapatite et la dentine [84].
- Un groupement fonctionnel phosphate (certains monomères fonctionnels ont comme groupement fonctionnel un groupement phosphonate ou carboxyle) [85]. Le groupement fonctionnel acide peut soit déminéraliser l’hydroxyapatite, soit s’y lier chimiquement selon la définition du concept d’adhérence décalcification (CAD) [86]. Selon le CAD, des molécules acides adhèrent d’abord à l’hydroxyapatite par interaction électrostatique, ensuite, soit elles restent collées par la formation de sels de calcium/monomère suivant la voie d’adhésion, soit elles se décollent facilement (s’il n’y a pas de production de sels stables), provoquant une importante déminéralisation qui suit la voie de la décalcification.
La voie que suit le monomère fonctionnel dépend de sa structure moléculaire [87].
Application d’une couche de résine hydrophobe sur la couche d’adhésif
De plus en plus de praticiens utilisent des adhésifs universels contenant un ou plusieurs monomères fonctionnels, dont le plus fréquent le 10- MDP. Ce dernier est sensible à l’hydrolyse [83], comme évoqué précédemment. Après photopolymérisation de la couche d’adhésif, il est donc conseillé d’appliquer une couche de résine hydrophobe (ex : composite fluide) sur la couche d’adhésif afin de stabiliser et de protéger l’interface collée contre la dégradation hydrique [88].
Noter que lors de réalisation de restaurations indirectes, cette étape est réalisée automatiquement lors d’un protocole de scellement immédiat de la dentine IDS.
Pour les restaurations directes en composite, nous privilégierons l’application d’une fine couche de composite fluide en fond de cavité. Outre la protection contre l’hydrolyse, cette couche permettra également un amortissement des contraintes internes et des chocs [89, 90].
Finir les préparations avec des fraises de faible granulométrie
Une épaisseur importante de la boue dentinaire peut diminuer l’adhérence de certains systèmes adhésifs auto-mordançants ou universels utilisés en mode SAM qui n’ont pas la capacité d’imprégner une couche de boue dentinaire épaisse. Il est donc conseillé de finir les préparations avec une fraise de faible granulométrie (bague rouge). En effet, l’épaisseur de la boue dentinaire est corrélée avec la granulométrie de la fraise utilisée comme évoqué préalablement [91]. Cette recommandation a une action sur l’étanchéité immédiate et par conséquent sur l’étanchéité retardée du joint et sur sa dégradation dans le temps.
Polymérisation efficace
Une couche d’adhésif bien polymérisée, améliorant le taux de conversion de la résine adhésive, est une condition fondamentale à la stabilité à long terme de l’interface collée [83]. Il est important de ne pas négliger l’étape de photopolymérisation et de ne pas réduire son temps. De plus, le système adhésif doit toujours être photopolymérisé séparément et avant l’application de composite (restauration ou de collage) dès qu’il est appliqué sur de la dentine. En effet, l’absorption par osmose de l’humidité de la dentine par la surface de l’adhésif est ainsi réduite ou bloquée [92, 93, 94]. La photopolymérisation de la couche adhésive doit être effectuée rapidement après son application, sinon, des gouttelettes d’eau finissent par s’incorporer dans l’interface de l’adhésif [95, 96]. Ces gouttelettes et les pores qu’elles produisent affaiblissent l’interface collée et diminuent la longévité clinique des restaurations [81].
Prévention du risque carieux, bonne hygiène
Comme évoqué précédemment, le joint collé supporte mal l’acidité [97] et la présence de bactéries. Toute mesure de prévention et de motivation à l’hygiène orale des patients sera garante d’une meilleure pérennité des restaurations adhésives.
Déporter les joints collés des contraintes occlusales
Afin de prévenir la dégradation du joint collé par usure, le joint collé dent/restauration doit être situé en dehors des contacts occlusaux [98].
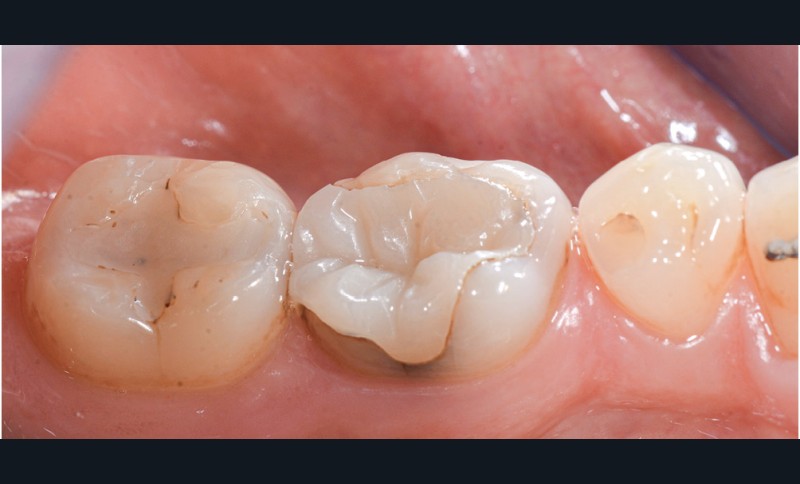
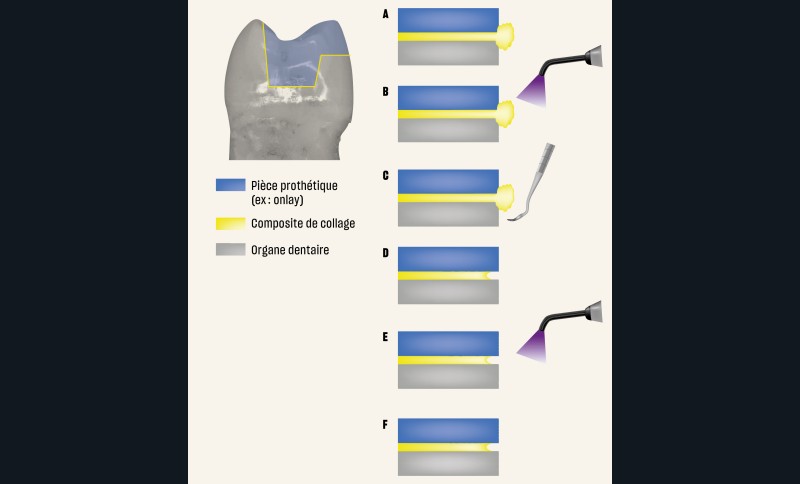
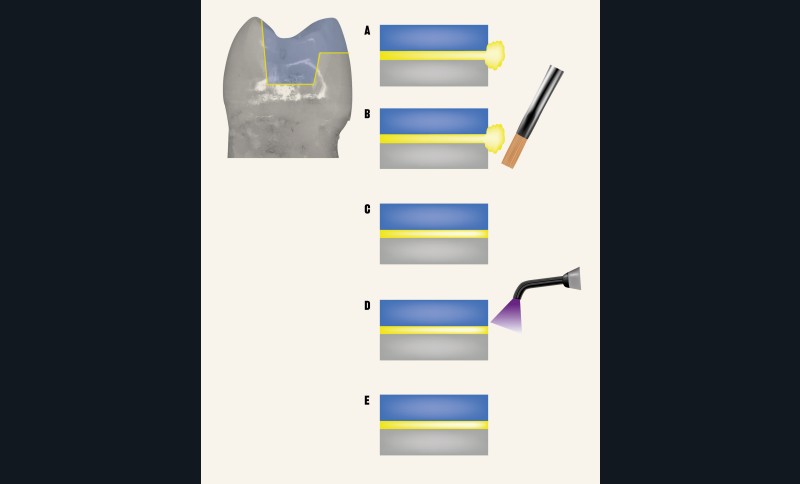
Éviter d’éliminer les excès de colle après une polymérisation flash
Lors du collage d’une restauration indirecte, de nombreux protocoles cliniques proposent une polymérisation flash de 2 ou 3 secondes suivie par l’élimination de la résine en excès à l’aide d’une curette, d’une sonde ou tout autre instrument, puis une nouvelle polymérisation plus longue est effectuée. Bien que ce protocole puisse sembler séduisant car il permet d’éliminer plus facilement les excès de colle, il est à proscrire car il induit un joint de mauvaise qualité en arrachant de la colle non assez polymérisée à l’intérieur du joint. Il en résulte souvent un joint qui n’est pas en continuité avec la dent, et la restauration devient source de coloration, de rétention de plaque dentaire, de biofilm bactérien dont l’acidité contribue à la dégradation du joint [97]. En conclusion, il faut proscrire les polymérisations « flash » (fig. 11 et 12).
Polymérisation à l’abri de l’oxygène de l’air
En 1991, Bergmann et al. préconisent de protéger le joint collé par un gel de glycérine lors de collage d’inlay afin de prévenir l’inhibition de polymérisation par la présence d’oxygène. Les conclusions apparaissent intéressantes car, outre la prévention de la formation de la couche d’inhibition, on améliorerait l’adaptation marginale et la résistance à l’usure du joint et donc sa pérennité [99]. Cette étape est devenue un gold standard de la photopolymérisation des composites de restauration et de collage. Cependant, aucune étude dans la littérature ne vient corroborer qu’une telle pratique permet d’améliorer la longévité des restaurations adhésives en ralentissant la dégradation du joint collé.
|
Tableau 1. Tableau récapitulatif des différentes stratégies pour prévenir la dégradation du joint collé |
|
STRATÉGIES POUR PRÉVENIR LA DÉGRADATION DU JOINT COLLÉ |
|
1- Utiliser un adhésif qui contient des monomères fonctionnels 2- Privilégier un mordançage sélectif de l’émail à l’acide phosphorique (Adhésif Universal utilisé en mode SMA sur la dentine avec mordançage sélectif de l’émail à l’acide phosphorique) 3- Avoir une photopolymérisation efficace 4- Appliquer une couche de résine hydrophobe sur la couche d’adhésif 5- Finir les préparations avec des fraises de faible granulométrie 6- Prévenir le risque carieux et informer sur la nécessité d’une bonne hygiène bucco-dentaire 7- Utiliser la chlorhexidine inhibiteur des MMPs 8- Déporter les joints collés des contraintes occlusales 9- Éviter d’éliminer les excès de colle après une polymérisation flash 10- Polymériser à l’abri de l’oxygène de l’air |
Conclusion
La plupart des systèmes d’adhésif dentaire actuellement utilisés donnent des résultats immédiats favorables qui reflètent une bonne rétention et une étanchéité des interfaces collées [100]. Malgré cet effet immédiat, les interfaces collées aux tissus dentaires peuvent ne pas résister au vieillissement et peuvent montrer une dégradation à long terme. De nombreuses propositions sont actuellement étudiées et proposées pour contrecarrer les effets de cette dégradation. Aucune à ce jour ne s’est révélée parfaite. L’association de plusieurs d’entre elles permet cependant d’obtenir des résultats intéressants pour prolonger la pérennité des restaurations collées.












Commentaires