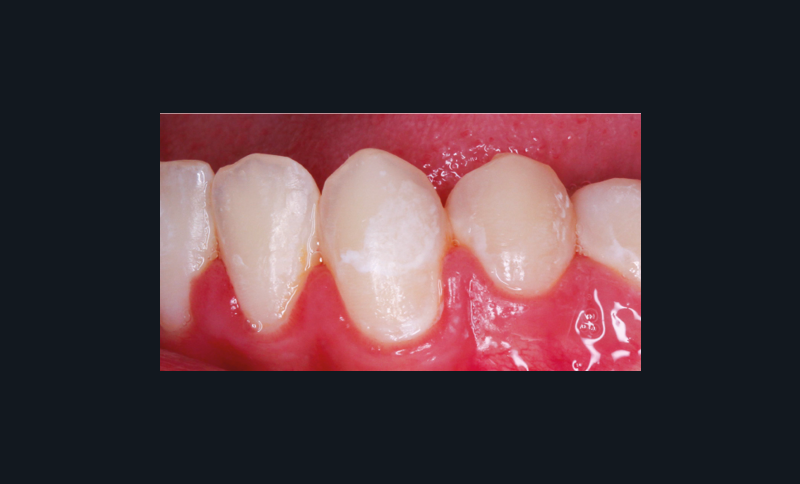
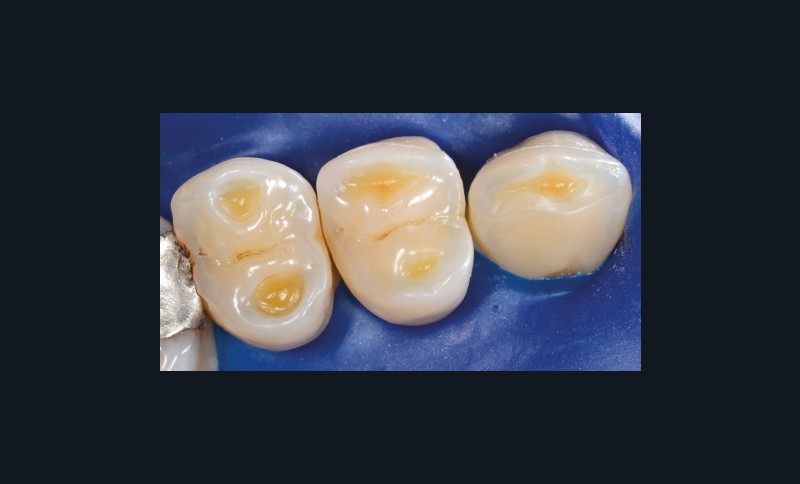
Ces pathologies, notamment les lésions d’origine non carieuse, sont en forte progression dans les pays industrialisés du fait des habitudes alimentaires actuelles. D’après une étude de 2013 de Barlett et al., près de 30 % de la population âgée de 18 à 35 ans présente au moins une dent à un stade avancé d’usure érosive [1]. Plus récemment, une étude de 2015 de Muller-Bolla et al. indique une prévalence de l’érosion jusqu’à 57 % de la population étudiée [2].
Une autre source de réflexion porte sur les conséquences de la déminéralisation de la dentine lors des processus de collage. En effet, l’intégralité de la couche dentinaire déminéralisée n’est pas infiltrée par les monomères résineux et est source de mécanismes de dégradation [3].
L’objectif des thérapeutiques actuelles est donc de stopper ces phénomènes de déminéralisation pour permettre une reminéralisation « biologique ». On parle même de reminéralisation biomimétique [4-6].
Mais en quoi consiste exactement le processus ?
La déminéralisation
La première phase du cycle correspond à la déminéralisation. Elle se définit comme la fuite de certains éléments minéraux constitutifs (calcium, phosphate) des tissus minéralisés par dissolution acide [7]. Celle-ci provient donc soit de la production d’acides dans le biofilm avec une libération d’ion H+, soit d’une origine intrinsèque ou extrinsèque. Lorsque la solution acide entre en contact avec l’émail, elle diffuse à travers le biofilm. Ce n’est qu’après qu’elle peut interagir directement avec les tissus minéralisés de la dent, et plus précisément avec les cristaux d’hydroxyapatite qui composent l’émail, puis pénétrer dans le gel aqueux qui occupe le réseau des pores de l’émail. Il se produit donc une perturbation des équilibres ioniques au niveau de l’interface tissu dentaire/gel aqueux du biofilm [8].
En dessous…