L’objectif de cet article est de définir et de présenter les éléments essentiels relevant de la réglementation des DM et de celle des DMSM qui sont applicables à l’équipe du cabinet dentaire.
Réglementation des dispositifs médicaux
L’entrée en application du règlement relatif aux dispositifs médicaux (UE 2017/745) est active depuis le 26 mai 2021. Ce nouveau cadre réglementaire renforce les exigences attendues des dispositifs médicaux (conception, études et évaluations cliniques, fabrication et commercialisation) pour garantir une plus grande sécurité des patients, des professionnels de santé ainsi que la qualité des soins, y compris des soins bucco-dentaires [1-7].
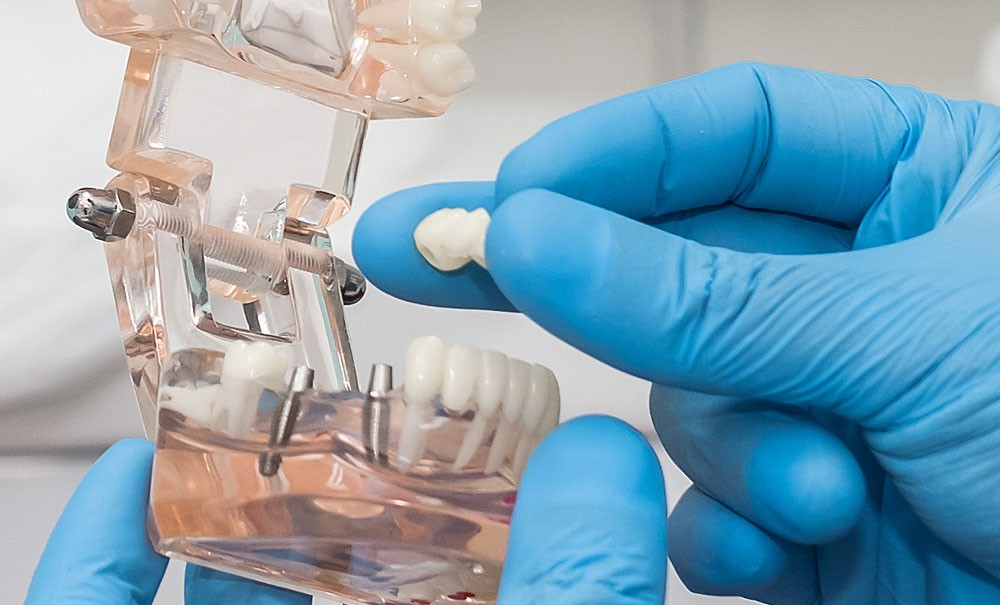
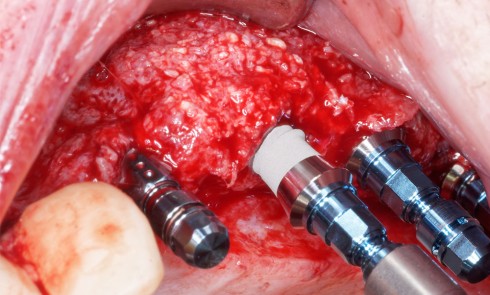
L’utilisation des DM fait partie intégrante du quotidien de l’équipe du cabinet dentaire [8].
Qu’est-ce qu’un dispositif médical ?
Littéralement, la définition d’un dispositif médical est la suivante : « Tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article, destiné par le fabricant à être utilisé, seul ou en association, chez l’homme pour l’une ou plusieurs des fins médicales précises suivantes :
- diagnostic, prévention, surveillance, prédiction, pronostic, traitement ou atténuation d’une maladie ;
- diagnostic, contrôle, traitement, atténuation d’une blessure ou d’un handicap ou compensation de ceux-ci ;
- investigation, remplacement ou modification d’une structure ou fonction anatomique ou d’un processus ou état physiologique ou pathologique ;
– communication d’informations au moyen d’un examen in vitro d’échantillons provenant du corps humain, y compris les dons d’organes, de sang et de tissus et dont l’action principale voulue dans ou sur le corps humain n’est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens » [1].
Cette définition est fixée par la réglementation…