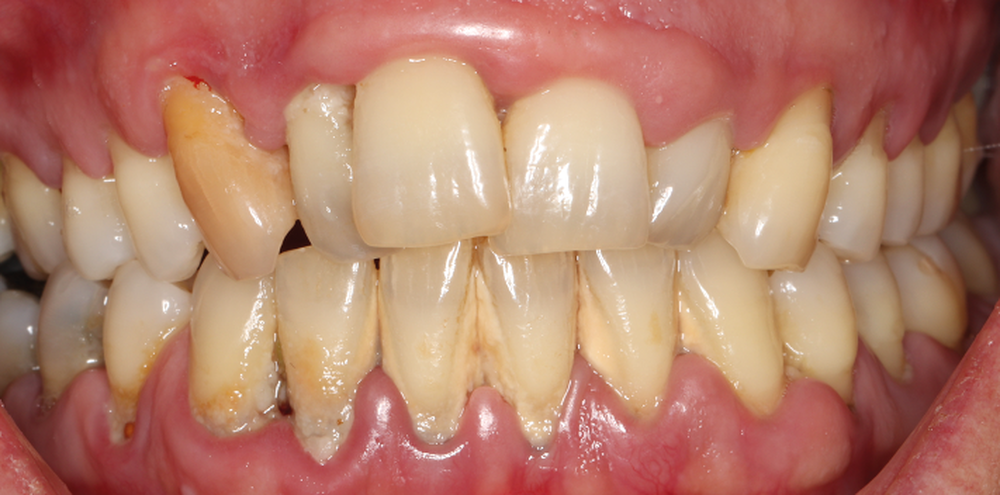
La parodontite est une maladie inflammatoire associée à une dysbiose, affectant 50 % des adultes et survenant plus fréquemment chez les hommes [1,2] (fig. 1). Elle entraîne la destruction des tissus de soutien tels que l’os alvéolaire, le ligament parodontal et le cément [1]. Elle est considérée comme la sixième maladie la plus répandue dans le monde et est la principale cause de perte dentaire. La charge économique mondiale due à la seule parodontite sévère a été estimée à 54 milliards de dollars chaque année [3], ceci mettant en évidence la nécessité d’une prise en charge efficace afin d’améliorer la qualité de vie des patients mais également de réduire leur impact sur les systèmes de santé.
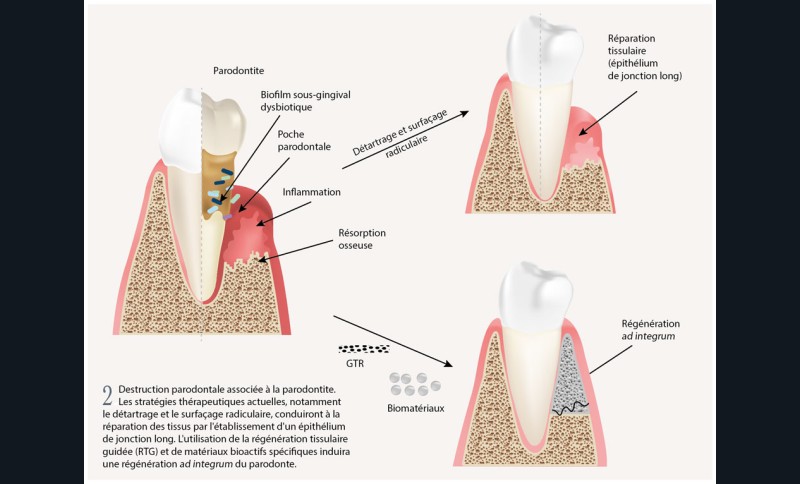
Actuellement, le traitement parodontal consiste en une phase non chirurgicale (instrumentation sous-gingivale) associée ou non à un traitement adjuvant tel que l’utilisation d’antibiotiques ou d’antiseptiques. En cas de progression plus avancée de la maladie, une approche chirurgicale peut être nécessaire [4]. Cependant, dans la majorité des cas, une réparation du tissu lésé caractérisée par un épithélium de jonction long est obtenue, et non une régénération ad integrum du parodonte [5] (fig. 2).
Selon le type de défaut et la quantité de parois osseuses résiduelles, différentes procédures de régénération avec plusieurs types de biomatériaux tels que les dérivés de la matrice amélaire (DMA), les substituts osseux ou les membranes ont été proposées [6]. En effet, les DMA induisent une régénération parodontale dans les défauts intra-osseux profonds et étroits [6] et leur utilisation est susceptible d’augmenter de 2,46 fois la possibilité d’améliorer le niveau d’attache clinique (CAL) dans les lésions parodontales de 22° par rapport aux lésions parodontales de 36° [7].
En l’absence de parois osseuses ou dans les défauts larges, une greffe osseuse…